- ホーム
- >
- 細胞生物学用語集トップ
- >
- 新着細胞生物学用語集(細胞骨格関連)
新着細胞生物学用語集(細胞骨格関連)
| リン脂質とアクチン細胞骨格 |
|---|
| 【Phospholipids and actin cytoskeleton】 |
| 伊藤 俊樹 |
| 神戸大学大学院医学研究科 |
アクチン細胞骨格は、負に帯電した細胞膜の直下において機能することから、酸性脂質(主にリン脂質)による直接的な制御を受けるのではないかと考えられてきた。実際、試験管内において、イノシトールリン脂質PIP2を含む人工膜小胞(リポソーム)をカエル卵抽出液中に添加すると、「アクチンコメット」と呼ばれる重合体を形成しながら運動する様子が観察される。これはリン脂質が直接アクチンの重合を促進する証拠であるが、この現象には多数のアクチン結合/調節タンパク質が関与している。profilin、cofilin、gelsolin、α-actininなどの直接アクチン線維の形成に作用するタンパク質を始め、ERMタンパク質、talin、vinculinなどの細胞膜との接触点に関与するタンパク質、N-WASPやWAVEなどのArp2/3複合体の活性化因子に至るまで、非常に多岐に渡るアクチン調節タンパク質がリン脂質と直接結合し、その機能制御を受けることが知られている。一般的に、リン脂質との結合はアクチン重合因子の活性を促進し、逆にアクチン重合を阻害する因子やアクチン線維を切断する因子に対しては阻害的に作用する傾向がある。参考文献 |
| Rhoファミリー低分子量Gタンパク質による細胞骨格の制御 |
|---|
| 【Regulation of cytoskeletons by Rho family small GTPases】 |
| 遠藤 剛 |
| 千葉大学大学院理学研究科 |
| 細胞内のアクチン細胞骨格と微小管はダイナミックに変化するが,その制御の中心的な役割を担っているのがRhoファミリー低分子量Gタンパク質である.哺乳類ではRhoファミリータンパク質は約20存在するが,これらのうちで特にRhoA, Rac1, Cdc42についての研究が進んでいる.これらはいずれも,細胞外のシグナル分子とそれらの受容体により活性化されたGDP/GTP交換因子(GEF)が作用して活性化される.すなわち,GDPを結合した不活性化状態からGTPを結合した活性化状態に変換される.活性化されたRhoファミリータンパク質は,標的タンパク質(エフェクタータンパク質)に結合して作用を現す.またGTPを結合したRhoファミリータンパク質にGTPase活性化タンパク質(GAP)が作用すると,GTPase活性が促進されてGTPを加水分解し,GDPを結合した不活性化状態にもどる. Cdc42は標的タンパク質のmDia2やN-WASPを介して,束状のアクチン線維を形成し,糸状仮足(filopodia)の形成を引き起こす.またRac1は標的タンパク質のWAVE複合体を介して,枝分かれしたアクチン線維のネットワークを形成し,葉状仮足(lamellipodia)の形成に働いている.RhoAは標的タンパク質のmDia1を介してアクチン線維を形成し,またROCK(Rhoキナーゼ)を介してアクチン・ミオシン相互作用を引き起こす.これによりストレスファイバーとフォーカルアドヒージョン(接着斑)の形成がもたらされる.走化性因子に向かって細胞が遊走する場合には,細胞前方(先導端)に形成される糸状仮足が走化性因子を含む細胞周辺の環境を探り,また葉状仮足が細胞体の移動に働く.さらにストレスファイバーが細胞後方(尾部)の退縮に働く.こうしてCdc42, Rac1, RhoAが時空的に協調して働くことにより,細胞遊走がもたらされる. 遊走している細胞は前方が広がった扇状の形態をとる.このような細胞では,核の前方に微小管形成中心(MTOC)が配置して,そこから微小管が伸長・短縮している(動的不安定性).微小管が伸長するプラス端は細胞前方に配向し,アクチン線維やフォーカルアドヒージョンに結合すると安定化する.Cdc42とRac1は標的タンパク質のPar6, IQGAP1, PAKを介して,核前方へのMTOCの配置,および微小管の安定化や細胞膜への結合に働く.またRhoAもmDia1, mDia2を介して微小管の安定化に働く.このようにCdc42, Rac1, RhoAは遊走細胞の極性(方向性)の形成にもかかわっている. 参考文献(1) 渡邊晴子,高野和儀,遠藤 剛 (2006) 蛋白質 核酸 酵素 増刊「細胞骨格と接着」,51, 683-692.
(2) Jaffe, A.B., Hall, A. (2005) Annu. Rev. Cell Dev. Biol. 21, 247-269. (3) Rottner, K., Stradal, T.E. (2011) Curr. Opin. Cell Biol. 23, 569-578. |
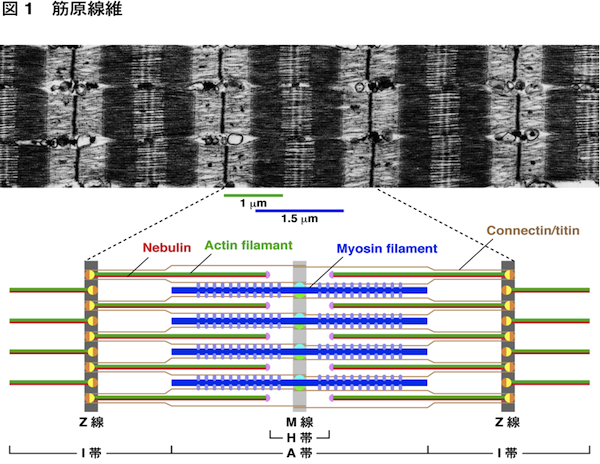
| 筋原線維(筋原繊維) |
|---|
| 【Myofibril】 |
| 遠藤 剛 |
| 千葉大学大学院理学研究科 |
| 骨格筋や心筋は収縮することにより,からだの各部の動きや心臓の拍動を担っている.この収縮を担っている筋細胞内の構造が筋原線維である.筋原線維は直径が約1 μmで細長い円筒状の構造で,筋細胞内にぎっしり詰まっている.筋原線維を構成するミオシン線維がアクチン線維をたぐり寄せて滑り込ませることにより,筋収縮が起こる.アクチン線維は長さが約1 μmに揃っている.その反やじり端はZ線(Z帯,Z盤)に入り込んでおり,Z線で固定されている.一方,ミオシン線維は長さが約1.5 μmに揃っている.中央のM線(M帯)から両側に向かって伸びており,M線で固定されている.Z線から次のZ線の間をサルコメア(sarcomere)と呼び,筋原線維の構成単位である.
コネクチン/タイチン(connectin/titin)は分子量が3,000-3,700 kDaの最大のタンパク質であり,Z線とM線をつないでいる.ばねの働きをする部位があり,ミオシン線維をサルコメアの中央に位置させたり,受動的張力によりサルコメアの長さを保持している.またネブリン(nebulin)は骨格筋特異的に発現している分子量が600-900 kDa,長さが約1 μmの巨大タンパク質で,Z線からアクチン線維のほぼ全長にわたって伸びている.Z線からアクチン線維が形成される時には,ネブリンに沿って伸長する.心筋にはネブリンは存在せず,代わりに長さが約0.15 μmのネブレット(nebulette)が存在している.α-アクチニン(α-actinin)はZ線に局在して,アクチン線維同士を架橋している.アクチン線維の溝に沿って,トロポミオシン(tropomyosin)とそれに結合したトロポニン(troponin)複合体(T, I, Cの3つのサブユニットから成る)が存在している.トロポニンはミオシンとアクチンの相互作用を阻害するが,トロポニンにCa2+が結合することにより,この阻害が解除されて筋収縮が起こる.筋原線維中のトロポミオシン-トロポニンを含むアクチン線維を細い線維(thin filament)と呼ぶ.一方,ミオシン線維には,ミオシン結合タンパク質C(MyBP-C),M線に局在するMタンパク質(M-protein)やマイオメシン(myomesin)などが結合している.筋原線維中のこれらのタンパク質を結合したミオシン線維を太い線維(thick filament)と呼ぶ.筋原線維にはこれらのタンパク質以外にもいくつものタンパク質が存在するが,機能が十分に解明されていないものも多い. 筋細胞はインスリン様増殖因子1(IGF-1)が作用することによって肥大するが,その過程で筋原線維が形成される.IGF-1によって活性化されたホスファチジルイノシトール3-キナーゼ(PI3K)-Aktシグナリングを介して,Z線でネブリンのC末端にN-WASPが結合する.この複合体がアクチン重合核形成因子として働き,Z線でアクチン重合核が形成される.さらにZ線からネブリンに沿ってアクチン線維が伸長する.こうして筋原線維のアクチン線維が形成される.一方,IGF-1によるミオシン線維形成の機構はまだ不明である. 参考文献(1) Clark, K.A., et al. (2002) Annu. Rev. Cell Dev. Biol. 18, 637-706.
(2) Lange, S., Ehler, E., Gautel, M. (2006) Trends Cell Biol. 16, 11-18. (3) 高野和儀,遠藤 剛 (2011) ライフサイエンス新着論文レビュー (4) 高野和儀,渡邊-高野晴子,遠藤 剛 (2011) 実験医学 29, 1273-1276. |
| cAMPによるアクチン細胞骨格制御 |
|---|
| 【cAMP-regulated actin cytoskeleton】 |
| 福原 茂朋・望月 直樹 |
| 国立循環器病研究センター研究所 細胞生物学部 |
| お問合せ |
cAMPがA-キナーゼではなく、Epac (低分子量GTP結合蛋白質Rap1のグアニンヌクレオチド交換因子)の活性化によりGTP-Rap1を増加させる。さらにCdc42の活性化が生じるとともに、血管内皮細胞では、β/α-カテニンを介したVascular endothelial cadherin (VE-cadherin)とcortical actin cable (CAB)の結合が促進される。また一方、Rhoの抑制によるventral stress fiberの抑制も見られる。結果としてVE-cadherinの細胞間接着の安定化により、相対的に細胞-細胞間接着が増強され、細胞―基質間接着が減弱されることになる (図参照)。Rap1がどのようなシグナルでCdc42を活性化するのか?, Cdc42がいかにしてCABの形成を促進するのか?は不明である。Epacが発現する細胞種によってEpacの下流因子が変わるために(心臓ではRap1-PLCepsilon, 膵臓ではKチャンネルなど)アクチンの制御に関わるのがはっきりしているのはRap1-Cdc42系のシグナルが明らかな血管内皮細胞だけである。血管内皮細胞ではアドレノメデュリン受容体やアドレナリン受容体などのGs-アデニル酸シクラーゼ系を活性化するG蛋白質共役型受容体が発現するためにcAMP-Epacによるアクチン骨格制御系が機能する。A-キナーゼによるアクチン細胞骨格の直接制御についても上皮細胞・内皮細胞ともに明確な調節機構は明らかにされていない。参考文献1. Noda K, Zhang J, Fukuhara S, Kunimoto S, Yoshimura M, Mochizuki N. Vascular Endothelial-Cadherin Stabilizes at Cell-Cell Junctions by Anchoring to Circumferential Actin Bundles through a- and b-Catenins in Cyclic AMP-Epac-Rap1 Signal-activated Endothelial Cells. Mol Biol Cell. 21:584-96, 2010
2. Fukuhara S, Sakurai A, Sano H, Yamagishi A, Somekawa S, Takakura N, Saito Y, Kangawa K, Mochizuki N. Cyclic AMP potentiates VE-cadherin-mediated cell-cell contact to enhance endothelial barrier function through Epac-Rap1 siganaling pathway. Mol. Cell Biol. 25: 136-146, 2005 |
| 酵母のアクチン細胞骨格 |
|---|
| 【The actin cytoskeleton in yeasts】 |
| 中野 賢太郎 |
| 筑波大学大学院生命環境科学研究科 |
| お問合せ |
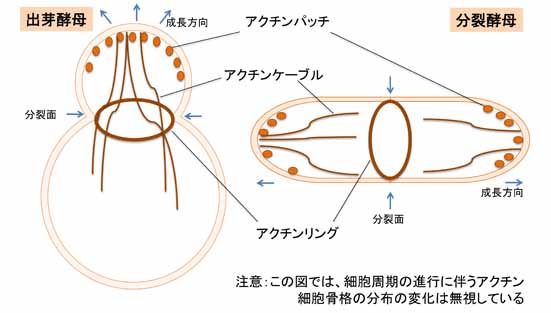
| 基礎研究に用いられる酵母は、主に出芽酵母 (budding yeast, Saccharomyces cerevisiae) と分裂酵母 (fission yeast, Schizosaccharomyces pombe) である。両者の進化系統の隔たりは大きいが、アクチン細胞骨格 (actin cytoskeleton) の性状については共通性が高い。そのため、酵母の研究から得られた知見は、真菌類のみならず真核生物全般にも当てはまる場合が多い。酵母の実験系では、条件致死性を利用した遺伝学的解析や相同組換えによる目的遺伝子の破壊が容易であり、細胞機能に必須な遺伝子の機能解析が自在に出来る。この特質により、アクチン、及びその調節タンパク質の細胞内の分子機能の研究において、両酵母は重要な地位を占める。
酵母には、アクチンパッチ (actin patch)、アクチンケーブル (actin cable)、そしてアクチンリング (actin ring) の3種類の構造が認められる。アクチンパッチは細胞質側に貫入した細胞膜領域を覆うように比較的短いアクチン繊維が取り巻いたもので、エンドサイトーシス (endocytosis) の際に小胞を切り離す役割を担う。通常、細胞の成長領域や分裂面では、複数のアクチンパッチが頻繁に形成と解体を繰り返す。また、それらの細胞領域から細胞質中に数本のアクチンケーブルが伸長する。これはV型ミオシン (myosin V) のレールであり、成長領域への物質輸送に寄与する。一方、アクチンリングは分裂期にのみ出現する構造で、II型ミオシン (myosin II) を構成成分として含む。これは動物細胞の収縮環に相当し、細胞質分裂 (cytokinesis) に伴い、その径を縮める。補足すると、アクチンリングの収縮に付随して、分裂面に新しい細胞壁(隔壁)が新生されることも酵母の細胞質分裂には重要である。なお酵母においては、動物細胞のように細胞膜直下を裏打ちするアクチン細胞骨格のメッシュワークは報告されていない。このような構造は、細胞壁で被われた酵母には不要なのだろう。 上記の3種類の構造の構築において、先導的な役割を担うアクチン重合促進タンパク質は、アクチンパッチでは Arp2/3 複合体 (Arp2/3 complex) が、アクチンケーブルやアクチンリングではフォルミン (formin) である。これらの活性は、Rho ファミリーの低分子量 GTPase の制御下に置かれているらしい。またアクチン束化タンパク質 (actin-bundling protein) やキャッピングタンパク質 (actin-capping protein) 、脱重合タンパク質 (actin-depolymerizing factor) などについても、動物細胞や植物細胞のものと酵母のものとで共通性が高い。 参考文献 |
| ビンキュリン |
|---|
| 【vinculin】 |
| 木岡 紀幸 |
| 京都大学大学院農学研究科 |
| お問合せ |
アクチン繊維と結合し、主に、細胞外マトリックス-細胞間の接着装置である接着斑(focal adhesion)と細胞-細胞間の接着装置であるアドヘレンス・ジャンクション(adherens junction)の両方に存在するタンパク質。ビンキュリンは頭部と尾部およびそれらをつなぐリンカー領域からなっており(図)、尾部にはアクチンが、頭部にはタリン(talin)やαカテニン(α-catenin)が結合する。タリンなどのタンパク質との相互作用を介して、ビンキュリンは接着斑の成熟やその接着強度に貢献している。リンカー領域にも細胞増殖シグナルに関わるビネキシン(vinexin)やインスリンのシグナル伝達に関与するCAP/ポンシン、アクチン重合の核形成因子Arp2/3が結合する。ビンキュリンとアクチンなどの結合タンパク質との親和性は頭部と尾部の分子内相互作用により低く抑えられており、分子内相互作用の解離に伴いその親和性が著しく増大する(活性化)。この活性化の仕組みは現在論争中であるが、複数の結合相手が同時にビンキュリンに作用することが活性化を引き起こすという「組合せモデル」が有力である。また接着斑でのビンキュリン-タリン結合およびアドヘレンス・ジャンクションでのビンキュリン-αカテニン結合が細胞内張力によって調節されることから、ビンキュリンはメカノトランスダクション(mechanotransduction)にも関与していると考えられている。参考文献Carisey, A. and Ballestrem (2011) Eur J Cell Biol 90 157-163. Kioka, N. (2002) Cell Struct Func 27 1-7. 木岡紀幸(2007) 生体の科学 58 430-431. |
| タリン |
|---|
| 【talin】 |
| 辻岡 政経 |
| 大阪大学大学院理学研究科 |
| お問合せ |
接着斑と呼ばれる細胞接着構造を構成する分子の一つ。およそ270kDaの大型のタンパク質で、FERMドメインと呼ばれる50kDa程度の球状領域と220kDa程度のロッド状領域からなる。脊椎動物は二つのタリン(talin)遺伝子を持ち、このうちの一方(talin1)について重点的に研究されてきた。接着斑では、接着分子であるインテグリン(integrin)が細胞外基質と結合し、その細胞質側でタリンをはじめ、多様なタンパク質と複合体を形成している(図1)。タリンはα鎖とβ鎖からなるインテグリンのβ鎖に結合して構造変化を引き起こし、接着可能な状態にすると同時にアクチンフィラメントにも結合して両者を繋ぐ。加えてアクチン結合タンパク質ビンキュリン(vinculin)やFAKキナーゼなどのタンパク質とも結合して複合体の核となり、接着斑の成熟、接着斑を介した細胞内外のシグナル伝達、力伝達に重要な役割を果たす。実際、talin1の機能を阻害した細胞は接着に異常を生じる。また、talin1欠損マウスは胚性致死である。近年ではもう一方のタリン(talin2)の解析も着手されており、両者の機能重複が報告される一方、性質の違いや異なる接着斑への局在など、特有の機能も示唆されている。タリンはホヤやショウジョウバエ、線虫、細胞性粘菌などにも広く存在する。なかでも粘菌は、二つのタリンの同時欠損株が単離されている唯一の生物であり、この変異細胞は基質に全く接着できない。さらに、この二つのタリンは粘菌の発生の異なる時期に働いており、タリンの機能の重複と特異性が示唆された最初の例である。参考文献 |
| 細胞性粘菌におけるアクチン細胞骨格 |
|---|
| 【Actin-cytoskeleton in Dictyostelium cells】 |
| 祐村 恵彦 |
| 山口大学大学院医学系研究科 |
| お問合せ |
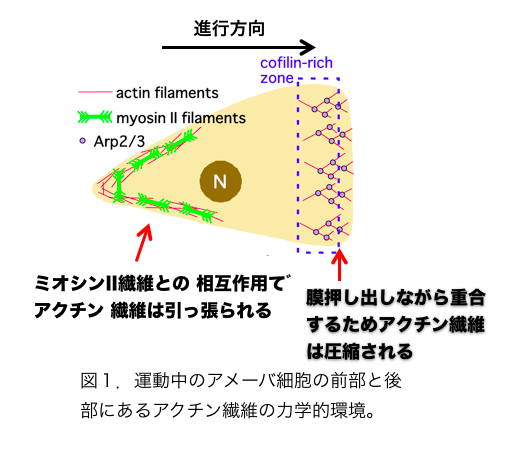
土壌生物である細胞性粘菌は,その生活環に単細胞と多細胞の時期を持つ。単細胞は走化性運動により集合することで多細胞になる。この細胞の運動は白血球に酷似しており,白血球や動物細胞の細胞運動のモデル生物として研究されている。細胞の運動機構は,細胞前端部でのアクチン繊維重合による細胞膜の押し出しと,細胞尾部に局在するミオシンII(骨格筋のミオシンに似る)によるATP依存的な尾部収縮によると考えられている。細胞性粘菌の細胞のアクチン繊維の細胞内分布を蛍光ファロイジン染色で調べると,仮足に最も多くのアクチンが存在しており,ストレスファイバーのような大きな束構造はない。これ以外にも,細胞膜を裏打ちする構造,点状の基質接着部位,尾部ではミオシンIIと相互作用できるようなアクチン繊維束が存在する。細胞質には多量の単量体のプールが存在し,細胞前端部でのアクチン繊維はArp2/3複合体により,Y字に枝分かれした状態で膜の方から重合が進行する。重合には多くのアクチン結合タンパク質が関与する。細胞分裂の最終段階である細胞質分裂時には,分裂面にアクチンとミオシンIIからなる収縮環が形成され,この構造の収縮により,細胞は2つの嬢細胞に分断される。ミオシンII欠損細胞では,収縮環依存の細胞質分裂ができないため,多核化する。参考文献Yumura, S. and T. Q. P. Uyeda. (2003).
Myosins and cell dynamics in cellular slime molds. International Review of Cytology, 224:173-226. PubMed |
| ミオシンの局在制御機構と細胞運動 |
|---|
| 【Regulation of myosin II for subcellular localization and cell motility】 |
| 祐村 恵彦 |
| 山口大学大学院医学系研究科 |
| お問合せ |
ここでは,タイプIIのミオシンIIについてのみ解説する。このミオシンは骨格筋ミオシンに似ており,双極性の繊維を形成することができる。ミオシンIIは分裂細胞では,細胞質分裂時に収縮環に,移動細胞では細胞の尾部に局在する。ミオシンIIが局在する場所でアクチン繊維との相互作用により,力を発生し細胞質分裂,移動運動,さらに形態形成などに寄与していると考えられる。ミオシンIIの遺伝子を欠損させる実験が細胞性粘菌で初めて行なわれ,この欠損細胞では,収縮環依存の細胞質分裂ができないため,多核化することが示された。これ以前に,馬淵らによる,ミオシンに対する抗体を顕微注射すると細胞質分裂が阻害されるという歴史的実験もミオシンIIが細胞内で局在してその場所で力を出すことを示している。ミオシンII欠損細胞でも移動運動は可能であるが,尾部の収縮ができず,仮足でのアクチンの重合による伸長のみにより移動運動することになり速度も遅くなる。ミオシン繊維の形成はミオシンIIの細胞内局在には必須で,繊維化できない改変ミオシンでは局在が見られなくなる。ミオシンIIの繊維の制御と酵素の活性化の制御はリン酸化に依存するが,その修飾は生物によって軽鎖もしくは重鎖,もしくは両方が関与する。ミオシンIIが収縮環や細胞尾部にどのように局在するかは,まだよく分かってない。リン酸化の酵素活性が細胞内で偏っておれば,繊維を局所に集合させることができるという考え(リン酸化勾配説),アクチンを含めた細胞膜の流れがミオシンIIを分裂面や細胞尾部に運ぶ(表層流説),anillinのようなミオシンIIを分裂面にアンカーするタンパク質がある(結合タンパク質説)などが議論されている。最近,アクチン繊維が張力センサーとして機能していて,繊維が伸ばされる時にミオシンIIがより結合しやすくなるため,張力を発生し始めた部位にミオシンIIが集合するのではないかという斬新なアイデアが提唱されている。参考文献Mabuchi, I and M. Okuno (1977). The effect of myosin antibody on the division of starfish blastomeres. J Cell Biol. 74:251-263.
PubMed Uyeda T. Q. P. et al. (2011). Stretching actin filaments within cells enhances their affinity for the myosin II motor domain. PLoS One, e26200. PubMed Yumura, S. et al. (2008). Multiple mechanisms for accumulation of myosin II filaments at the equator during cytokinesis. Traffic, 9:2089-2099. PubMed |
| メカノトランスダクション |
|---|
| 【mechanotransduction】 |
| 米村 重信 |
| 理化学研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
機械的刺激(情報)を生化学的シグナルに変換すること。関連する言葉のメカノセンシング(mechanosensing)は機械的刺激を知覚することで、分子レベルでは、機械的刺激によって分子が構造変化を起こすことに対応する。メカノレスポンス(mechanoresponse)は機械的刺激から生体の反応(メカノトランスダクション以降に起こる、細胞骨格の変化や遺伝子発現など)が起こること。メカノトランスダクションは構造変化を起こした分子が、生化学的シグナルを引き起こす段階である。この場合の生化学的シグナルには、チャンネルの開閉、酵素活性の制御、タンパク質との結合などが含まれる。参考文献 |
| αカテニン |
|---|
| 【a-catenin】 |
| 米村 重信 |
| 理化学研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
主要な細胞接着分子カドヘリン(cadherin)に対して、βカテニン(β-catenin)とともに複合体を作り、カドヘリンに依存する細胞接着に対して必須な役割を果たすタンパク質。神経系ではαNカテニンという非常に近縁のタンパク質が発現しており、それに対して一般に見られるのはαEカテニンと呼ばれる。カドヘリン接着に関してはアクチン細胞骨格との結合に関わっているという細胞内のデータやアクチン繊維との結合の生化学的データが示されている。一方、カドヘリンカテニン複合体の状態ではアクチン繊維との生化学的な結合は認められず、細胞内でもアクチン繊維結合に対して何らかの制御があると考えられる。カドヘリンを主要な接着分子とするアドへレンス・ジャンクション(adherens junction)において、カドヘリンカテニン複合体が張力を受けた時に、αカテニンはアドへレンス・ジャンクションの主要なアクチン結合タンパク質ビンキュリン(vinculin)と結合するようになる(アドへレンス・ジャンクションを補強する)機能を持ち、メカノトランスダクション(mechanotransduction)を担っているタンパク質の一つである。また、細胞接着以外に細胞の増殖などにも関与している。参考文献 |
| 非筋ミオシンIIのリン酸化による制御 |
|---|
| 【Regulation of non-muscle myosin II function by its phosphorylation】 |
| 米村 重信 |
| 理化学研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
非筋細胞におけるミオシンIIはそのリン酸化によってATPase活性や会合能が制御されている。これは細胞の局所において、必要な時間だけミオシンIIが機能するためだと考えられている。常にアクチン繊維との相互作用によって収縮運動を行う骨格筋におけるミオシンIIではリン酸化による活性や会合能の制御が失われている。主要な調節を担うリン酸化を受けるのは生物種によって重鎖である場合と調節軽鎖(myosin regulatory light chain: MRLC)である場合があるが、ここではショウジョウバエから哺乳類まで広く見られるMRLCのリン酸化について述べる。哺乳類の場合、MRLCの19番目のセリン、18番目のスレオニンが順次リン酸化を受け、リン酸化を多く受ける程ATPase活性も会合したミオシンIIフィラメントも安定性も上昇することが生化学的にわかっている。ショウジョウバエではMRLCの変異体ではミオシンII活性に依存する細胞質分裂が異常になり、その異常はリン酸化されない変異MRLCでは回復せず、野生型あるいは疑似リン酸化型のMRLCの導入によって回復した。これらのことによりミオシンIIのリン酸化による制御の重要性がわかる。19番目のセリンのみがリン酸化されているMRLC (1P-MRLC)を認識する抗体、18番目のスレオニンと19番目のセリンと両方がリン酸化されているMRLC (2P-MRLC)を認識する抗体がそれぞれ作られている。野生型MRLC、リン酸化されない変異MRLC、擬似リン酸化型変異MRLCなどを細胞に発現させ、ミオシンIIのダイナミクスを観察すると、1P-MRLCは会合したミオシンIIと同じ局在を示すが、収縮しつつある場所には2P-MRLCが多いこと、ミオシンIIの細胞内の局所的な集積離散にはリン酸化脱リン酸化を繰り返すことのできるMRLCが重要であることがわかる。細胞内でリン酸化を行っているキナーゼにはミオシン軽鎖キナーゼ(MLCK)、ROCK/Rho-kinase、citron kinase、MRCK、ZIP kinaseなどが報告されており、阻害剤やノックダウン、ノックアウトの実験からその重要性が指摘されている。脱リン酸化の方はMYPT1というサブユニットを含むミオシンフォスファターゼが担当している。ROCK/Rho-kinaseは直接MRLCをリン酸化する能力があるとともに、MYPT1をリン酸化することによりミオシンフォスファターゼ活性を抑制し、細胞内のミオシンリン酸化に大きな役割を果たしていることがわかっている。参考文献 |
| 植物ミオシン |
|---|
| 【plant myosins】 |
| 山本 啓一 |
| 千葉大学理学部生物学科 |
| お問合せ |
現在、ミオシンは二十数種に分類されているが、植物で働いているのはVIII型とXI型である。XIII型というミオシンがカサノリから発見されたがそれはXI型の一種と見なされることになった。VIII型は原形質連絡の開閉やエンドサイトーシスに関与し、XI型はオルガネラの輸送とそれに伴う原形質流動に関与すると考えられている。植物細胞は動物細胞と比べてサイズが桁違いに大きいので、細胞内の物質循環を拡散に任せるわけにはいかず、原形質流動という細胞質の流れを起こしている。この流れは、XI型ミオシンが、小胞体膜のネットワークを引きずりながら、アクチンフィラメント上を滑り運動することにより引き起こされる。車軸藻の節間細胞は長さが数cmもあり、その中では毎秒70マイクロメーターという速い原形質流動が起こっている。この流速は車軸藻ミオシンがアクチン上を動く速度そのものなので、車軸藻ミオシンは筋肉ミオシンの10倍以上の速さで動くことのできる世界一速いモータータンパク質と言える。動かない植物のミオシンが、動くことが特徴である動物の筋肉ミオシンより速いというのはどのような意味があるのだろう。実は、この速さゆえ、車軸藻ミオシンがATPの化学エネルギーを運動に変換する効率は低く、出せる力は筋肉ミオシンと比べるとかなり小さい。原形質流動を引き起こす力はあまり強くなくて良いので、車軸藻ミオシンはエネルギー変換効率を犠牲にして巨大細胞内での物質輸送の速さを追求したものと考えられる。モデル植物のシロイヌナズナにはVIII型ミオシン遺伝子が4、XI型ミオシン遺伝子が13存在する。シロイヌナズナXI型ミオシン遺伝子を1−2個ノックアウトしてもオルガネラの輸送速度や表現系に大きな変化は見られないので、ミオシン間で機能の重複があるようだ。推定される細胞内での役割と対応するように、VIII型ミオシンの酵素活性や運動活性はXI型ミオシンより低い。
参考文献Yamamoto, K.(2008) "Plant Myosins" Chapter 12 in "Myosins" Ed. by L. M. Coluccio Springer Netherlands Ito,K., Kashiyama, T., Shimada, K., Yamaguchi, A., Awata, J., Hachikubo,Y., Manstein, D. J., and Yamamoto, K. (2003) Biochem Biophys Res Commun, 312, 958-964. Yamamoto, K., Shimada, K., Ito, K., Hamada, S., Ishijima, A., Tsuchiya, T. and Tazawa, M. (2006) Plant Cell Physiol. 47, 1427-1431. 山本研究室ホームページ |
| 非筋ミオシンIIの分子種の特徴 |
|---|
| 【Properties of nonmuscle myosin II isoforms】 |
| 高橋 正行 |
| 北海道大学大学院理学研究院 |
| お問合せ |
非筋ミオシンII(nonmuscle myosin II)は、アクチンフィラメントを動かす、或いはつなぎ止めることで、細胞の形態変化を含む様々な過程(細胞質分裂、細胞遊走、細胞間及び細胞−基質間接着等)に関与するモータータンパク質である。二本ずつの重鎖(myosin heavy chain:MHC)、必須軽鎖(essential light chain)、調節軽鎖(regulatory light chain)からなる六量体であり、二個の球状の頭部と長い棒状の尾部をもつユニークな構造をもつ。頭部は、 ATPase活性部位とアクチン結合部位を含むモータードメインと,軽鎖結合部位であるレバーアームからなり、アクチンフィラメントを動かすモータータンパク質としての機能を担う。尾部はミオシンIIが会合して双極性のフィラメントを形成することに関与する。ミオシンIIはフィラメントを形成して機能することにより、複数のアクチンフィラメントを同時につなぎ止める構造タンパク質としての役割も持つ。ほ乳類には三種類のミオシンII重鎖アイソフォーム(MHC-IIA,-IIB,-IIC)が存在し,それぞれがホモダイマーを形成してミオシンIIA,IIB,IICとなる。さらに、IIBとIICには頭部のLoop1(ATPase site 近傍)及びLoop2(アクチン結合部位近傍)に短い挿入配列をもつスプライスバリアント、B1、C1及びB2、C2が存在する。B1、B2、C2は神経組織特異的に発現している。IIAのノックアウトマウスは、近位内胚葉層形成の異常と細胞間接着の欠陥により胎生6.5日目で死亡する。IIBのノックアウトマウスは、その発現が多い組織である脳と心臓に発生異常が起こり、ほとんどが胎生14.5日目で死亡する。IIAは他のアイソフォームよりも高いモータータンパク質としての活性を示す。IIBは他のミオシンIIと比べて異常に高いduty ratio (1回のATP加水分解サイクルにおけるアクチンに結合している時間の割合)を示すことから、構造タンパク質としての役割が強い可能性もある。一方、IICは全ヒトゲノム塩基配列決定後、新たにその存在が明らかになったアイソフォームであるが、そのノックアウトマウスに顕著な異常は見られない。それぞれのアイソフォームにおいて、組織特異的な発現様式、また細胞内局在の違いも報告されており、重複した機能の他にアイソフォーム特異的な機能があることが考えられる。参考文献 |
| 非筋ミオシンIIの会合 |
|---|
| 【Assembly of nonmuscle myosin II】 |
| 高橋 正行 |
| 北海道大学大学院理学研究院 |
| お問合せ |
ミオシンスーパーファミリーの中でミオシンIIの際立った特徴は、会合して双極性のフィラメント(bipolar filament)を形成することである。両端に頭部を向けた双極性のフィラメント構造をとることにより、極性をもつアクチンフィラメントを両方向からたぐり寄せられる。その結果、細胞内のアクチン細胞骨格を収縮させる、或いは骨格に張力をかけることができる。ミオシンIIの会合は分子同士の静電相互作用による。会合に必須な領域(Assembly Competence Domain: ACD)は重鎖(myosin heavy chain)のα-helical coiled-coil構造からなる尾部のC末端近傍にあることがわかってきている。非筋ミオシンII(nonmuscle myosin II)のフィラメントは横紋筋ミオシンの太いフィラメント(thick filament)よりもかなり小さく、15〜30個程の分子でできている。横紋筋ミオシンはサルコメア構造内で常に太いフィラメントを形成しているのに対し、非筋ミオシンIIは細胞内で然るべき時に然るべき部位に集まって会合し、アクチンフィラメントと共に収縮性の構造体を一時的に形成する。精製したミオシンIIのin vitroにおける解析から、ミオシンIIは不活性な状態では棒状の尾部が二箇所で折り畳まれた、会合できないコンフォメーションをとり、調節軽鎖(regulatory light chain)のSer19(場合によってはThr19も)がリン酸化されると、頭部のモーター活性が上昇するのと同時に尾部が伸びたコンフォメーションに変化し会合できるようになると考えられている。細胞性粘菌のミオシンIIのフィラメント形成は重鎖のリン酸化により調節されている。一箇所で折れ曲がった尾部が脱リン酸化により伸びて会合できるようになる。脊椎動物のミオシンIIも軽鎖のリン酸化に加えて、重鎖のリン酸化による調節機構もあることがわかってきている。尾部の重鎖C末端のACDの近傍とnonhelical tailpiece(α-helical coiled-coil構造がほどけた領域)と呼ばれる領域に、PKC、CK II、TRPM7等によるリン酸化部位が存在し、リン酸化により会合能が減少する。また、他のタンパク質との相互作用による会合調節機構も存在する。S100A4/Mts1はミオシンIIアイソフォーム(IIA、IIB、IIC)のうちIIAだけに特異的に結合し脱会合状態に保たせる。その結果、ガン化した細胞の転移能を増加させることが示唆されている。参考文献 |
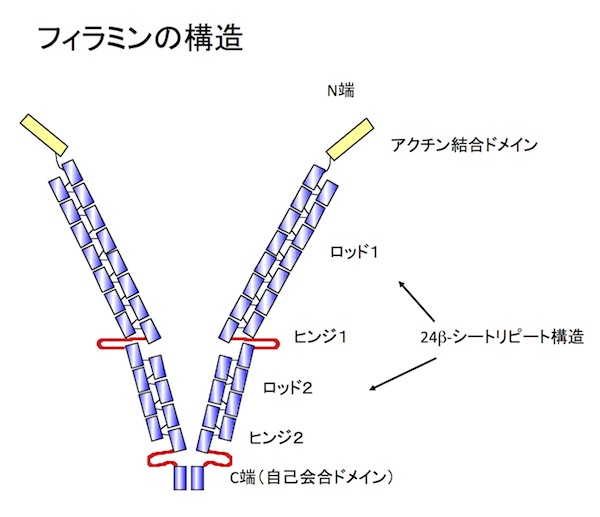
| フィラミン |
|---|
| 【Filamin】 |
| 太田 安隆 |
| 北里大学理学部生物科学科 |
| お問合せ |
フィラミンは、アクチン繊維架橋タンパク質のひとつで、細胞皮層のアクチン繊維ネットワークの主要な構成分子の1つである。3種類のフィラミン(A, B, C)が知られている。このうちフィラミンAとBは各種臓器で発現してるが、フィラミンCは筋肉でのみ発現している。フィラミンは、分子量約280kDのサブユニットがC端で自己会合した2量体で、N端側のアクチン結合部位を使って、アクチン繊維を格子状に架橋してゲル構造を作ることができる(図1)。フィラミンAは、チャンネルタンパク質、受容体、タンパクキナーゼなど90種類以上の分子と結合し、シグナル伝達の足場タンパク質として機能している。血管内皮細胞の血流に対する応答や結合組織内を移動している白血球の運動など、細胞は様々な力学的な刺激に反応しながら生きている。フィラミンAは、細胞外からの力学的な力に応じてそのコンフォメーションを変化させ、インテグリンなどのフィラミン結合分子との相互作用を変化させることで力学的な刺激に対する細胞応答に関与することができる。フィラミン遺伝子の変異が複数の遺伝性疾患の原因であることがわかっている。例えばヒトにおいて、フィラミンの変異は脳室周囲異所性灰白室(フィラミンA)、家族制心臓弁膜ジストロフィー(フィラミンA)、boomerang dysplasia(骨異形成症)(フィラミンB)、筋原線維性ミオパチー(フィラミンC)を引き起こす。参考文献参考文献 Cell Adh Migr.5:160-9, 2011 (PMID: 21169733) |
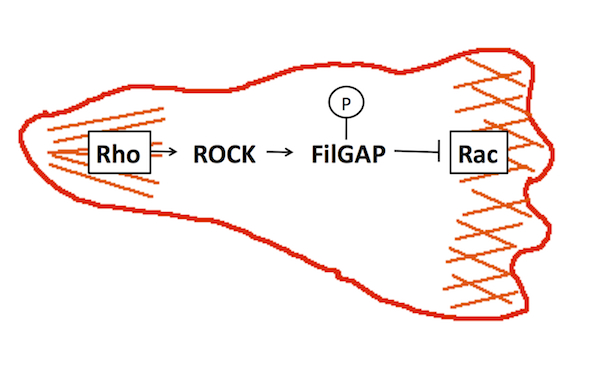
| フィルギャップ |
|---|
| 【FilGAP】 |
| 太田 安隆 |
| 北里大学理学部生物科学科 |
| お問合せ |
FilGAPは、低分子量GTP結合タンパク質 Racを特異的に不活化する因子GAP (GTPase-Activating Protein)の一つで、アクチン繊維架橋因子フィラミンに結合する。FilGAPを欠失した細胞は、細胞周囲に葉状仮足をランダムに進展させることからFilGPAは葉状仮足の形成制御に関与していると考えられる。FilGAPは、低分子量GTP結合タンパク質Rhoの標的タンパク質であるROCKキナーゼでリン酸化されると活性化される。細胞運動においては、Racが細胞の前部で活性化され葉状仮足を進展し、Rhoはミオシンを活性化し、収縮を促すことで細胞尾部を決定している。この細胞前部と尾部でのRacとRhoの特異的な活性化は、両者が互いに阻害し合っているからだと考えられており、FilGAPはRhoの下流でRacを不活化することで、RacとRhoの棲み分けに関与していると考えられる(図1)。FilGAPは、構造の似た他のRacGAPとファミリーを形成しており,メンバーとしてARHGAP22とARHGAP25が知られている。FilGAPの研究は北里大学理学部生体機能学講座のホームページに詳しく紹介されている。参考文献参考文献 Nat Cell Biol. 8:803-814, 2006 (PMID: 16862148) |
| 中間径フィラメント(中間径繊維) |
|---|
| 【Intermediate filaments (IFs)】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
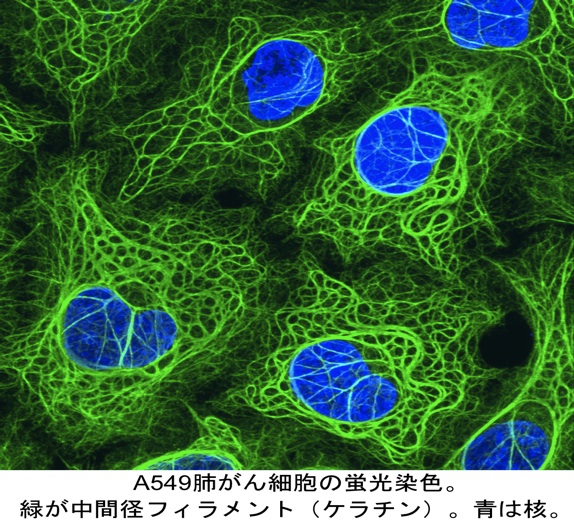
| 中間径フィラメント(fig1)は、アクチン繊維、微小管とならび細胞骨格を構成する主要3繊維の一つである。その名は、筋組織の電子顕微鏡観察においてミオシンIIの太いフィラメントとアクチンの細いフィラメントの中間の太さを示したことに由来するが(石川春律博士ら、文献1)、その太さ(10nm)はアクチン繊維と微小管の中間でもある。特徴として、これら3つの繊維の中では生化学的に最も溶けにくく、物理的には最も引っ張りに強い。そのため、細胞に機械的強度を付与していると考えられ、このことは変異動物や遺伝学の解析結果からも裏付けられている(教科書1, 2; 総説1; 以下同様)。
このような強い繊維構造は構成蛋白質同士が重合することによって構築される。その種類は複数あり、それぞれの相同性も互換性も低いが、構造的な類似によってフィラメント自体は同じサイズの似た性質となる。つまり、基本構造は長い棒状ドメイン(rod)とそれを挟む頭部(head)・尾部(tail)からなり、また重合に寄与する配列には保存性がある。 中間径フィラメントの種類についてみると、無脊椎動物にも類縁は存在するが少ない。一方、高等脊椎動物は中間径フィラメント構成蛋白質の種類が最も多く複雑である。それらは6つのグループに分けられ、重合できるグループは決まっている。さらにその発現に厳密な組織特異性が見られる。すなわち、ケラチン(keratin)は上皮細胞に、ビメンチン(vimentin)は結合組織細胞に、デスミン(desmin)は筋細胞に、GFAP (glial fibrillary acidic protein)はグリア細胞にそれぞれ発現する。 この特性は、医学領域においては腫瘍の分化マーカーとして利用されている。これを細胞生物学的に詳しく見れば、上皮の中間径フィラメントとしてのケラチンの特異性は高いが、そのサブタイプは20を超える。また、神経、筋、結合組織ではビメンチンをはじめ重なり合って発現する他の蛋白質がいくつかある。この冗長性が、中間径フィラメントの機能解析を困難にしている。 しかし近年の実験技術や遺伝子工学の進展により、各中間径フィラメントに特異的に結合する蛋白質が同定されるようになってきた。その中には、細胞種特異的な機能とよく相関を示すものがある(総説1, 2; 文献2, 3, 3', 4, 4'; 中間径フィラメント結合蛋白質の項も参照)。このことから、中間径フィラメントはこれら結合蛋白質にとっての足場(scaffold)でもあり、高等脊椎動物にみられる細胞種特異的な発現は、それぞれの細胞特性の付与に貢献しているのではないかと考えられるようになり、新たな注目を集めている。 参考文献文献1) Ishikawa H, Bischoff R, Holtzer H. J Cell Biol. 1968 Sep;38(3):538-55.
文献2) Kim S, Wong P, Coulombe PA. Nature. 2006 May 18;441(7091):362-5. 文献3) Sugimoto M, Inoko A, et al. J Cell Biol. 2008 Oct 6;183(1):19-28. 文献3') "Research Highlight" Nat Rev Mol Cell Biol. 2008 Nov;9:825 文献4) Inoko A, Matsuyama M, et al. J Cell Biol. 2012 Apr 30;197(3):391-405. 文献4') "In Focus: Trichoplein keeps primary cilia silent" J Cell Biol. 2012 Apr 30;197(3):341. 教科書1) 細胞の分子生物学 第5版 第16章 細胞骨格, NEWTON PRESS 教科書2) ルーイン細胞生物学 第4部 細胞骨格 9 中間径フィラメント, 東京化学同人 総説1) Fuchs E, Cleveland DW. Science. 1998 Jan 23;279(5350):514-9. 総説2) Coulombe PA, Wong P. Nat Cell Biol. 2004 Aug;6(8):699-706. |
| 中間径フィラメントのリン酸化による構築制御 |
|---|
| 【Role of phosphorylation on the disassembly of IFs】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
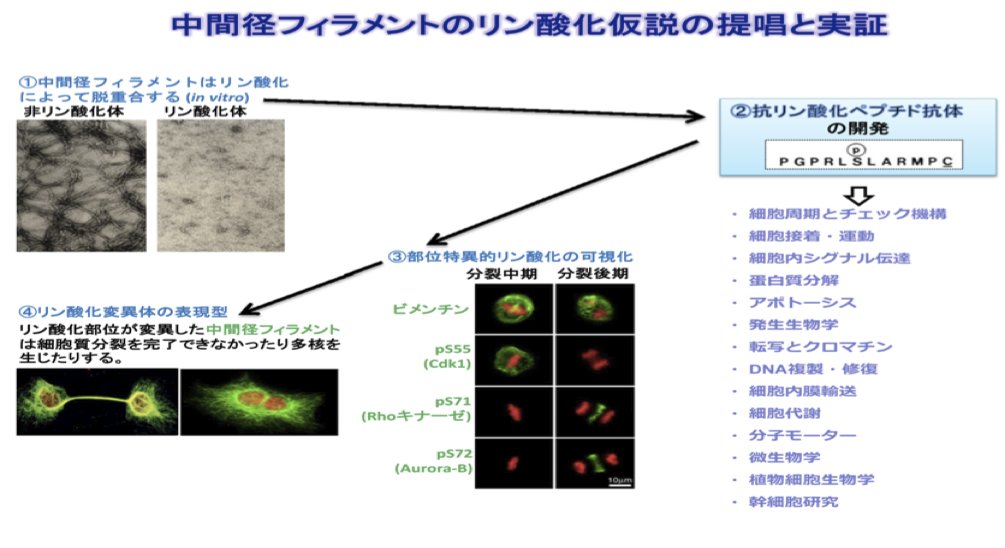
| 中間径フィラメント(中間径繊維と同義)はリン酸化により脱重合する。つまり、アクチン繊維や微小管と違い、基本的に濃度に依らない構築制御を受ける。そもそも中間径フィラメントは、非常に安定な不溶性の静的構造物と見なされていたため(中間径フィラメントの項を参照)、構築制御機構についての分子レベルでの理解は遅れていた。しかし1987年、稲垣昌樹博士ら(リンク1, 2)の報告により、中間径フィラメントの繊維構造がキナーゼによるリン酸化を受けて脱重合することがin vitroのビメンチン(vimentin)を用いた実験により明らかになった(fig1(1), 文献1)。この発見は、中間径フィラメントを動的な構造物として捉えなおす転機となり、従来の概念を変えたとされる。
この脱重合は細胞内現象として確認される必要があったため、アミノ酸残基のリン酸化を部位特異的に認識する抗体すなわち「抗リン酸化ペプチド抗体 (site- and phosphorylation state-specific antibody)」が同グループにより開発され、その作成から応用までが方法論として確立された(fig1(2), プロトコール1-3)。これらを用いた免疫染色により、ビメンチンが細胞分裂時に受ける複数の部位特異的リン酸化が可視化され、またそれぞれに特異的なキナーゼ(Cdk1, Rho-kinase, Aurora-B)が同定された(fig1(3); 総説1, 2)。さらにこのリン酸化部位を欠陥変異で置き換えると細胞質分裂が完了できなくなることを確認し(fig1(4))、このリン酸化による構築制御仮説は細胞現象、特に細胞分裂との関わりで実証された。 今、この方法論は細胞周期制御における重要なキナーゼカスケードの同定にも貢献している(fig1(2), 総説3)。 今後、このようなリン酸化変異体の影響を個体レベルで検討することが期待され、その研究は新展開を見せつつある。 参考文献リンク1) 愛知県がんセンター研究所・発がん制御研究部(稲垣昌樹研究室)
リンク2) 名古屋大学グローバルCOEプログラム 文献1) Inagaki M, Nishi Y, Nishizawa K, Matsuyama M, Sato C. Nature. 1987 Aug 13-19;328(6131):649-52. 総説1) Izawa I, Inagaki M. Cancer Sci. 2006 Mar;97(3):167-74. 総説2) 猪子誠人・後藤英仁, 中間径フィラメントの構築制御機構と細胞内機能, 細胞骨格と接着・蛋白質核酸酵素・2006年5月号増刊 (貝淵弘三・稲垣昌樹・佐邊壽孝・松崎文雄 編), 51, 551-558, 2006 総説3) 後藤英仁・稲垣昌樹, G2/M移行期におけるCDK1の活性化およびチェックポイント解除機構, 細胞周期フロンティア (佐方功幸・稲垣昌樹・岸本健雄 編),52-57, 共立出版, 2010 プロトコール1) Goto H, Inagaki M. Nat Protoc. 2007;2(10):2574-81. プロトコール2) 大海忍・辻村邦夫・稲垣昌樹 著, 抗ペプチド抗体実験プロトコール 新版, 秀潤社, 2004 プロトコール3) 後藤英仁・稲垣昌樹, Close Up実験法, 実験医学, 26, 2965-2972, 2008 |
| 中間径フィラメント結合蛋白質 |
|---|
| 【IF-associated proteins】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
| 中間径フィラメント(中間径繊維と同義)に結合する蛋白質。アクチン繊維や微小管の結合蛋白質と同様、繊維構造の安定化や架橋をすることで調節的に働くものがある一方で、やや趣を異にするものがある。それは細胞種固有の機能に大きく関与するものである(総説1-5)。
例えば、ケラチン(keratin)は上皮特異的な中間径フィラメントである(中間径フィラメントの項を参照)が、実はアポトーシス(apoptosis)に関わる蛋白質を結合させることで、そのシグナルの減弱に寄与している(文献1)。また、ケラチン17(keratin17)は創傷など増殖状態にある表皮で発現するケラチンであるが、これが14-3-3σを結合させて、蛋白質の生合成を促進させていることが明らかとなっている(文献2)。また、アルバトロス(Albatross)は上皮細胞の極性化に寄与する新規蛋白質であるが、ケラチンはこの蛋白質に結合し、これを安定化することで上皮分化に促進的に働くことが示された(文献3, 3')。 このように、中間径フィラメントが足場(scaffold)となることで、細胞種固有の機能に貢献していることがわかってきた。つまり、中間径フィラメント構成蛋白質が顕著な組織特異的発現を示すのには意味があると思われる。特にケラチンはがんの発生母地である上皮に特異的に発現しているため、結合蛋白質の同定により上皮機能との関与を新たに探す試みは、対極にあるがん化の新規メカニズムの発見にもつながることから、医学的にも重要であると思われる(リンク1, 2)。 参考文献総説1) Fuchs E, Cleveland DW. Science. 1998 Jan 23;279(5350):514-9.
総説2) Coulombe PA, Wong P. Nat Cell Biol. 2004 Aug;6(8):699-706. 総説3) Izawa I, Inagaki M. Cancer Sci. 2006 Mar;97(3):167-74. 総説4) 井澤一郎・稲垣昌樹, 中間径フィラメントの構築制御とシグナルクロストーク, 形と運動を司る細胞のダイナミクス・実験医学・2006増刊 (竹縄忠臣・遠藤剛 編), 58-63 総説5) 猪子誠人・後藤英仁, 中間径フィラメントの構築制御機構と細胞内機能, 細胞骨格と接着・蛋白質核酸酵素・2006年5月号増刊 (貝淵弘三・稲垣昌樹・佐邊壽孝・松崎文雄 編), 51, 551-558, 2006 文献1) Inada H, Izawa I, Nishizawa M, Fujita E, Kiyono T, Takahashi T, Momoi T, Inagaki M. J Cell Biol. 2001 Oct 29;155(3):415-26. 文献2) Kim S, Wong P, Coulombe PA. Nature. 2006 May 18;441(7091):362-5. 文献3) Sugimoto M, Inoko A, et al. J Cell Biol. 2008 Oct 6;183(1):19-28. 文献3') "Research Highlight" Nat Rev Mol Cell Biol. 2008 Nov;9:825 リンク1) 愛知県がんセンター研究所・発がん制御研究部(稲垣昌樹研究室) リンク2) 名古屋大学グローバルCOEプログラム |
| コフィリンによるアクチン骨格の制御 |
|---|
| 【Regulation of actin cytoskeleton remodeling by cofilin】 |
| 大橋 一正 |
| 東北大学大学院生命科学研究科 |
| お問合せ |
| コフィリンは、アクチン繊維を切断・脱重合する活性をもつ20 kDaのアクチン結合タンパク質である。酵母から存在し、生存に必須であり、ヒトまで高度に保存されている。コフィリンは、ヒトで遺伝子の異なる筋肉型、非筋肉型、Actin depolymerizing factor (ADF)の3種類が存在する。細胞内の数μモルの濃度で存在する。試験管内の実験により、繊維状のF-アクチン, 単量体のG-アクチンどちらにも結合することが明らかとなっている。また、ADP結合型のアクチンに対してより高い親和性を持ち、ADPの加水分解とリン酸の放出が進んだ古いアクチン線維を切断・脱重合すると考えられている。アクチン繊維の脱重合と切断は異なる作用で、アクチン線維のマイナス端からアクチンの脱重合する活性と、アクチン線維の側面に結合し、アクチン線維のらせん構造をよりねじれた状態にすることで不安定化して切断する作用があると考えられている。
細胞内における基本的なコフィリンの機能は、アクチン線維を切断・脱重合しアクチン骨格の流動性を生みだす働きである。細胞内のコフィリンの発現抑制や不活性化は、細胞内アクチンの過重合により重合と脱重合のターンオーバー速度の低下を引き起こし、アクチンの流動性が失われ、細胞は全く運動できない状態になる。 コフィリンのアクチン脱重合・切断活性に対する制御は、主に、ホスファチジルイノシトール4,5ビスリン酸(PIP2)との結合によるアクチン線維への結合阻害、3番目のセリン残基のリン酸化によるアクチン結合活性の不活性化、Actin interacting protein 1 (Aip1),アデニル酸シクラーゼ結合蛋白質(CAP)との結合による活性促進の制御が知られている。コフィリンのリン酸制御は、リン酸化酵素としてLIMキナーゼファミリー(LIMK1, LIMK2, TESK1, TESK2)が働き、脱リン酸化酵素としてSlingshotファミリー(Slingshot-1, Slingshot-2, Slingshot-3)が働く。これ以外にPP1, PP2A, ハロ酸デヒドロゲナーゼの一つでタンパク質脱リン酸化酵素として働くChronophinが脱リン酸化酵素として働くことが報告されている。コフィリンのリン酸化制御は、進化的にショウジョウバエ以降で保存されており、酵母にはLIMキナーゼ、Slingshotに相同な遺伝子は存在しない。 LIMキナーゼは、 LIMK1, LIMK2共に低分子量Gタンパク質Rhoファミリーの下流エフェクターのリン酸化酵素ROCK, PAKによってリン酸化され活性化される。LIMK1は、細胞移動に必要であり、ラメリポディア形成、ストレスファイバー形成において部分的に寄与する働きを持つと考えられている。Slingshotは、Slingshot-1について解析が進んでおり、アクチン線維と結合して強く活性化されること、Rhoファミリーの一つであるRacやPI3キナーゼの下流で活性化されること、Ca2+シグナルの下流でカルシニューリンによって活性化されることが報告されている。細胞外からの刺激依存的にLIMキナーゼと共に活性化され、コフィリンのリン酸化のターンオーバーを促進することでアクチン骨格の再構築に寄与すると考えられる。 参考文献 |
| ERMファミリー |
|---|
| 【ERM family】 |
| 田村 淳・月田 早智子 |
| 大阪大学大学院生命機能研究科 |
| お問合せ |
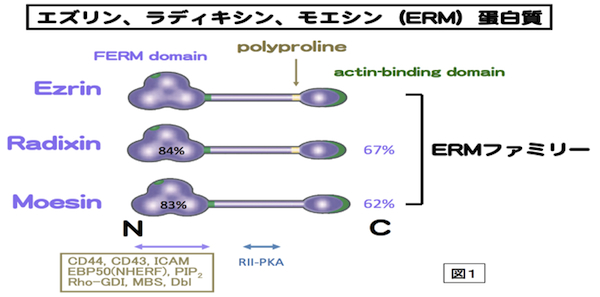
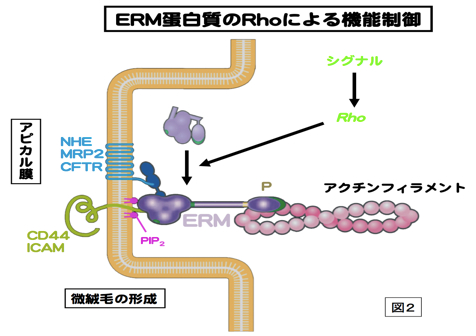
細胞骨格の1つであるアクチンフィラメントと細胞膜との動的な相互作用をつかさどる蛋白質ファミリー。微絨毛や神経成長錐、細胞分裂時の収縮環などアクチンフィラメントが細胞膜に結合する部分に局在する。アミノ酸レベルで75%程度の相同性を持つ3つの蛋白質Ezrin,Moesin,RadixinによりERMファミリーが形成され、各々の構成蛋白質はERM蛋白質とよばれる。いずれもN末側からFERMドメイン、α-ヘリックス領域、アクチン結合モチーフの順に並ぶドメインを持つ、分子量75kDaほどの分子である(図1)。エズリンとラディキシンは、モエシンにはないポリプロリンモチーフを余分に持つ。ERM蛋白質は、細胞膜-アクチンフィラメントを架橋する棒状の活性型と球状の不活性型の2つのコンフォメーションをとる。ERM蛋白質はRhoの下流で、PIP2により活性化されて、細胞膜とアクチンフィラメントに、各々、N末のFERMドメインとC末で結合すると考えられる。活性化型ERM蛋白質はC末のトレオニン残基のリン酸化により、安定化される。細胞膜との結合では、CD44などの細胞膜蛋白質に直接結合する場合と、トランスポーターなどの細胞膜蛋白質にPDZドメインをもつEBP-50を介して結合する場合がある(図2)。各々のERM蛋白質は、培養細胞では共発現することが多く、同じ局在を示すことも多いが、生体組織レベルでは、組織の種類によって異なる発現と局在を示す。例えば、肝細胞ではRadixinの発現が多く、腸管上皮細胞ではEzrinが、血管内皮細胞ではMoesinが多く発現している。Radixin、Ezrinのノックアウトマウスでは各々肝臓および胃の上皮細胞において、MRP2やHK-ATPaseのアピカル細胞膜への局在不全のためにDubin-Johnson型の高ビリルビン血症や胃酸分泌障害になる。上皮細胞アピカル表層構築に重要な蛋白質として、注目されている。参考文献 Tsukita, S., Yonemura, S. (1999)
Kikuchi, S., Hata, M., Fukumoto, K., Yamane, Y., Matsui, T., Tamura, A., Yonemura, S., Yamagishi, H., Keppler, D., Tsukita, S., Tsukita, S. (2002) Fehon, RG., McClatchey, AI., Bretscher, A. (2010) Arpin, M., Chirivino, D., Naba, A., Zwaenepoel, I. (2011) Neisch, AL., Fehon, RG. (2011) |
| アクチン繊維によるメカノセンシング |
|---|
| 【Mechanosensing by actin filaments】 |
| 上田 太郎 |
| 産業技術総合研究所 バイオメディカル研究部門 |
| お問合せ |
| アクチン繊維は弾性をもった二重らせんであり、引っ張ればわずかに長くなる[1,2,3]。Shimozawaら[4]は、蛍光標識したアクチンの蛍光強度がin vitroの張力負荷によって変化することを見出しているし、Matsushitaら[5]は、分子動力学シミュレーションにより、張力負荷がアクチン繊維の長さとらせんピッチ両方を伸ばすことを報告している。したがって張力負荷されたアクチン繊維の長さとらせんピッチがばねのように伸びることは間違いない。しかしこのことが直ちにアクチン繊維がメカノセンサーであることを意味するわけではない。アクチン繊維がメカノセンサーとして機能するためには、張力負荷によりアクチン繊維としての機能が変化し、何らかのシグナル伝達の起点になければならないからである。しかしアクチン繊維は弾性係数が大きく(バネとして固い)、生理的な張力負荷で伸びる割合が小さい(0.3%程度)ため、これがシグナル伝達の起点になるという考えは一般的ではなかった。
こうした状況にあって、2011年にアクチン繊維はメカノセンサーであることを示す論文が2報、わが国の研究者から発表された。論文発表は同じ2011年でも学会発表が先行していたという意味で第一にあげるべきは、名古屋大の早川、辰巳、曽我部らによる、コフィリンとアクチン繊維の相互作用に関する論文である[6]。彼らはin vitroの実験で、コフィリンは張力のかかったアクチン繊維と結合しにくく、また切断しにくいことを発見し、さらにセミインタクトおよびインタクトなhuman umbilical vein endothelial cells (HUVECs)において、コフィリンが張力のかかっていないストレスファイバーと選択的に結合することも示した。張力のかかっていないストレスファイバーが崩壊しやすいことは以前から知られており、アクチン繊維のメカノセンシングに依存したコフィリン活性がこの現象に関与すると示唆されたわけである。もう一つの例は張力に依存したアクチン繊維とS1(ミオシンIIのモータードメイン)の結合である[7]。これはもっぱら生きた細胞性粘菌細胞を用いた観察で、GFP−S1が張力がかかっている細胞内アクチン繊維と優先的に結合することを報告ている。この現象は、S1にアクチンとの親和性を高める変異が必要であること、またミオシンIIとアクチン繊維の相互作用を調節することが知られている既知のタンパク質に依存しないことなどから、張力のかかったアクチン繊維に特徴的な構造をS1が直接認識して優先的に結合したと解釈された。興味深いことに、ミオシンIIのS1は張力負荷アクチン繊維と優先的に結合したが、ミオシンIのモータードメインはそうした選択性を示さなかった。この現象は、ミオシンIIは本来、細胞後部でフィラメントを形成してアクチン繊維と相互作用し、張力を発生させるのに対し、ミオシンIは細胞前部に局在して張力発生には関与しないことと関連があるのかもしれない。現在のところ、アクチン繊維のメカノセンシングが関与することが示唆されているのは、コフィリンおよびミオシンIIとアクチン繊維の相互作用だけであるが、アクチン繊維の構造が張力負荷で変化するなら、他のアクチン結合タンパク質との相互作用もアクチン繊維のメカノセンシングにより様々な調節を受けていると推測される。 アクチン系細胞骨格と相互作用するメカノセンサーはすでにいくつか知られている[8,9,10,11,12]。一方、アクチン繊維は非常に多数の因子と相互作用する多機能構造であり、かつ細胞表層全体に張り巡らされたネットワークであるため、アクチン繊維自体がメカノセンサーであることには、細胞全体の活性をコーディネートしうるという意味で大きな生理的意義をもちうる。こうした観点から議論しておきたいことは、アクチン繊維の構造多型と機能分化の関連である。そもそもアクチン繊維が単体で構造的多型性をもつという概念はE.H.Egelmanらの電子顕微鏡観察によりかなり以前から提唱されていた[13,14,15] (ただし最近のFujiiらの電子顕微鏡観察[16]はアクチン繊維の構造多型性に否定的であり、決着はついていない)が、その生理的意義は不明確であった。しかしコフィリンを初めとする種々のアクチン結合タンパク質の結合が、アクチンサブユニットの構造を変化させることが明らかとなり[17]、これがアクチン結合タンパク質とアクチン繊維の結合が協同的であることの構造的基盤であると提唱され[18]、アクチン繊維の構造多型の生理的意義がおぼろげながら見えてきた。つまり、たとえばコフィリンがアクチン繊維のあるサブユニットに結合すると、そのサブユニットの構造が「コフィリン結合型」に変化し、さらにこの構造変化が隣接するサブユニットの構造もコフィリン結合型に変化させる(協同的構造変化)と、その隣接サブユニットとコフィリンの親和性が増加し、結果的にコフィリンのクラスターが形成される(協同的結合)という考え方である。一方、ミオシンIIがアクチン繊維に結合すると、張力とは無関係にアクチン繊維のらせんピッチがわずかに延びることが報告されており[19]、またHMM(ミオシンIIの可溶性断片)は、微量のATP存在下でアクチン繊維と協同的に結合することも報告されている[20]ので、ミオシンIIモーターとアクチン繊維の協同的相互作用にもコフィリンの場合と同様、アクチン繊維の協同的構造変化が関与する可能性がある。ただしらせんピッチの伸び縮みの方向が逆なので、コフィリン結合によるアクチン繊維の協同的構造変化と、ミオシンII結合によるアクチン繊維の協同的構造変化はまったく異なったものであろう。この仮想的メカニズムには、細胞内のアクチン繊維の機能分化を安定化させる作用が期待でき、大変魅力的である(図1,2)。 参考文献1. Kojima H, Ishijima A, Yanagida T (1994) Proc Natl Acad Sci U S A 91: 12962-12966.
2. Huxley HE, Stewart A, Sosa H, Irving T (1994) Biophys J 67: 2411-2421 3. Wakabayashi K, Sugimoto Y, Tanaka H, Ueno Y, Takezawa Y, et al. (1994) Biophys J 67: 2422-2435. 4. Shimozawa T, Ishiwata S (2009) Biophys J 96: 1036-1044. 5. Matsushita S, Inoue Y, Hojo M, Sokabe M, Adachi T (2011) J Biomech 44: 1776-1781. 6. Hayakawa K, Tatsumi H, Sokabe M (2011) J Cell Biol 195: 721-727. 7. Uyeda TQ, Iwadate Y, Umeki N, Nagasaki A, Yumura S PLoS One 6: e26200. 8. Yonemura S, Wada Y, Watanabe T, Nagafuchi A, Shibata M (2010) Nat Cell Biol 12: 533-542. 9. Sawada Y, Tamada M, Dubin-Thaler BJ, Cherniavskaya O, Sakai R, et al. (2006) Cell 127: 1015-1026. 10. Kee YS, Robinson DN (2008) Curr Biol 18: R860-862. 11. Pramanik MK, Iijima M, Iwadate Y, Yumura S (2009) Genes Cells 14: 821-834. 12. del Rio A, Perez-Jimenez R, Liu R, Roca-Cusachs P, Fernandez JM, et al. (2009) Science 323: 638-641. 13. Egelman EH, Francis N, DeRosier DJ (1982) Nature 298: 131-135. 14. Galkin VE, Orlova A, Schroder GF, Egelman EH (2010) Nat Struct Mol Biol 17: 1318-1323. 15. Orlova A, Prochniewicz E, Egelman EH (1995) J Mol Biol 245: 598-607. 16. Fujii T, Iwane AH, Yanagida T, Namba K (2010) Nature 467: 724-728. 17. Galkin VE, Orlova A, Lukoyanova N, Wriggers W, Egelman EH (2001) J Cell Biol 153: 75-86. 18. Ressad F, Didry D, Xia GX, Hong Y, Chua NH, et al. (1998) J Biol Chem 273: 20894-20902. 19. Tsaturyan AK, Koubassova N, Ferenczi MA, Narayanan T, Roessle M, et al. (2005) Biophys J 88: 1902-1910. 20. Tokuraku K, Kurogi R, Toya R, Uyeda TQP (2008) J Mol Biol 386: 149-162. |
| 細胞内アクチン濃度 |
|---|
| 【The intracellular actin concentration】 |
| 木内 泰 |
| 東北大学大学院生命科学研究科 |
| お問合せ |
ほとんどの真核細胞でアクチンは最も大量に存在するタンパク質で、その濃度は数百μMに達する。単量体アクチン(G-アクチン)とアクチン線維(F-アクチン)はおよそ1対1の比率で存在する。G-アクチンが重合しないで存在できる臨界濃度は0.1μMと低く、細胞質のG-アクチンはサイモシンβ4ファミリーを中心とする隔離タンパク質が結合することで重合が抑制されている。G-アクチンは、ADF/コフィリンによるF-アクチンの切断・脱重合によって細胞質にADP-G-アクチンとして放出され、プロフィリンによってADPがATPに交換されATP-G-アクチンとなり、再び重合に使われる。細胞質で他のタンパク質と結合していないG-アクチンやプロフィリンと結合しているG-アクチンは重合可能で、それらの濃度は細胞内でのアクチン重合速度を決定する重要な因子である。細胞質G-アクチンの大半は重合できないサイモシンβ4結合型G-アクチンであり、G-アクチンとサイモシンβ4が結合・解離を繰り返す平衡状態にある。細胞が外的刺激を受けアクチン重合が促進された場合、この平衡は解離側に動いて、大量に存在するサイモシンβ4結合型G-アクチンプールからG-アクチンが供給され、アクチン重合に使われる。このように細胞は、G-アクチンを高い濃度に保つことで刺激に応じた素早いアクチン重合を引き起こすことができる。最近開発されたs-FDAP法によって、細胞内でのG-アクチン濃度の経時的、空間的な変化が詳細に測定できるようになった。参考文献Pollard, T.D., Blanchoin, L., Mullins, R.D. (2000) Annu. Rev. Biophys. Biomol. Struct. 29: 545-576.
Carlier, M.-F., Pantaloni, D. (2007) J. Biol. Chem. 282: 23005-23009. Watanabe, N. (2010) Proc. Jpn. Acad., Ser. B 86: 62-83. Kiuchi, T., Nagai, T., Ohashi, K., Mizuno, K. (2011) J. Cell Biol. 193: 365-380. |
| 走化性とアクチン制御 |
|---|
| 【Chemotaxis and f-actin regulation】 |
| 上村 陽一郎・上田 昌宏 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| お問合せ |
走化性(あるいはケモタキシス、chemotaxis)とは、細胞が外界の化学物質の濃度勾配を認識して示す誘因あるいは忌避運動のことである。走化性は多くの生物現象で重要な役割をもち、例えば、胚発生、神経回路の形成、あるいはがん細胞の原発巣からの転移(metastasis)に走化性が利用されている。特に白血球(leukocyte)の一つである好中球(neutrophil)が走化性により炎症あるいは感染部位へ集まることが昔からよく知られている。走化性研究には上記の好中球や微生物である細胞性粘菌(Dictyostelium discoideum)が用いられており、これらの細胞は進化的に離れているものの、その分子機構はよく似ている。走化性物質(chemoattractantあるいはchemorepellant)は7回膜貫通のGタンパク質共役型受容体(G protein coupled receptor)により感知され、三量体Gタンパク質(trimeric G protein)を介して下流の細胞運動装置を制御する。細胞は運動方向に顕著な極性をもち、細胞の前方では盛んにアクチン重合(F-actin polymerization)がおこり、仮足(pseudopod)形成が促進される。一方、細胞の後方ではミオシンII(MyosinII)が局在し、収縮力(contractile force)を発生することで、方向性のある細胞運動を効率的に制御すると考えられる。アクチン重合が細胞前端で局所的に起こるしくみは断片的にしか明らかでないが、リン脂質の一つであるホスファチジルイノシトール三リン酸(phosphatidylinositol(3,4,5)trisphospate)がメディエーターとして重要であると考えられている。参考文献 |
| 微小管不安定化因子 |
|---|
| 【Microtubule Destabilizer】 |
| 岡田 康志 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| お問合せ |
| 微小管(microtubule)は動的なポリマーで、その構成タンパクであるα/β チューブリン(tubulin)のヘテロ二量体の重合と解離により伸長(growth)と短縮(catastrophe)を繰り返す(動的非平衡性dynamic instability)。細胞内には、多数の伸長を促進する因子と短縮を促進する因子の双方が存在しており、組織や細胞あるいは細胞周期などに応じて微小管のダイナミクスが調節されている。このうち前者を微小管安定化因子(microtubule stabilizer)、後者を微小管不安定化因子(microtubule destabilizer)あるいは微小管崩壊因子(microtubule catastrophe factor)と総称している。
これまで3種類の異なるタイプの微小管不安定化因子が知られている。 1つは、微小管をその途中で切断する酵素で、微小管切断因子(microtubule severing factor)と呼ばれている。カタニン(katanin, 日本語の刀にちなんで名付けられた)がその代表である。 2つめのタイプは、微小管の端に局在し、端からの脱重合を促進する酵素で、微小管脱重合因子(microtubule depolymerizing factor)と呼ばれている。モータータンパク質(motor protein)のキネシン(kinesin)の一種であるkinesin-13 (M型キネシン、マウスのKIF2やヒトのMCAKなど)や、kinesin-8 (出芽酵母のKip3 など)が代表である。 3つめのタイプは、チューブリン二量体に高い親和性で結合することで微小管の重合脱重合の動的平衡を脱重合側へ移動する蛋白(チューブリン隔離因子, tubulin sequestering factor)で、スタスミン(stathmin, OP18)が代表である。ただし、結晶構造の比較などから、スタスミンもkinesin-13と同様の微小管端での脱重合促進活性を持つと考えられている。 また、微小管の重合を阻害する薬剤のコルヒチン(colchicine)やノコダゾール(nocodazole)なども、微小管不安定化因子と呼ばれることがある。 参考文献 |
| 微小管切断因子 |
|---|
| 【Microtubule Severing Factor】 |
| 岡田 康志 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| お問合せ |
| 微小管切断因子(microtubule severing factor)とは、微小管を中途で切断する活性を持つ酵素である。椎名らの実験により細胞周期依存的な微小管切断活性の存在が示唆され、現在までに4種類の微小管切断酵素が同定されている。このうちEF1α以外の3種の蛋白は、膜輸送に関わるAAA蛋白VPS4と類縁で、katanin, spastin, fidgetin と名付けられている。このうちkataninは、分裂期細胞質中の微小管切断活性因子として同定され、日本語の刀に因んで命名された。Spastinおよびfidgetinは、それぞれ神経系の変異であるヒトの遺伝性痙性対麻痺(hereditary spastic paraplegia)およびマウスの自然変異体であるfidget(モジモジするという意味)の原因遺伝子として同定され、それぞれin vitroあるいはin vivoでの微小管切断活性が確認された。 変異体の解析により、これらの微小管切断因子は、細胞分裂における微小管の長さ・量の制御や、植物細胞の間期微小管の枝分かれ構造の形成・維持、線毛の調節、神経細胞での微小管の制御などの多様な機能を果たしていることが知られている。 VPS4自体には微小管切断活性は報告されていないが、リング状の12量体を形成して膜輸送蛋白複合体を解体する機能が知られている。リング状の6量体を形成するKataninやSpastinも、これと同様の機構で微小管を解体・切断すると提唱されている。 参考文献 |
| 古典的MAPs |
|---|
| 【Classical Microtubule-Associated Proteins】 |
| 久永 眞市 |
| 首都大学東京 / 大学院・理工学研究科 |
| お問合せ |
微小管(microtubule)を組織(主に哺乳動物の脳)や細胞から、重合・脱重合を繰り返して単離した時に、微小管を構成するチューブリン(tubulin)とともに取れてくるタンパク質で、微小管の重合や安定化活性をもつ因子。最初に見つかった微小管結合タンパク質(MAP)のため、古典的(classical)と呼ばれている。また、酵素活性など持たず、微小管壁に結合して、微小管間の距離を調節することから、構造的(Structural)MAPとも呼ばれることもある。MAP1ファミリーとMAP2/MAP4/Tauファミリーからなる。MAP1ファミリーにはMAP1A、MAP1B、MAP1Sがある。MAP1AとMAP1Bは主に神経細胞で発現し、MAP1Bは発達期の神経細胞で特に軸索(axon)に存在し、MAP1Aは成熟した脳の神経細胞の樹状突起(dendrite)に存在する。MAP1Sは多くの組織で発現している。いずれのMAP1も全長が翻訳された後、C末側の微小管に結合できる部分(軽鎖)が切断され、残りのN末側(重鎖)と複合体を形成して微小管に結合する。MAP1の軽鎖としてLC3も知られているが、これは最近オートファジー(autophagy)に関連する因子であることが判明している。MAP1は微小管安定化能を持つが、後述のMAP2よりは弱い。アクチンフィラメント(actin filament)にも結合できる。MAP2/MAP4/Tauファミリーは熱安定性で、特定の構造をもたない繊維状のタンパク質である。C末側に3-5つの微小管結合配列からなる微小管結合領域を持つ。N末側は微小管の外へ伸び出し、微小管間の距離を規定したり、他のタンパク質の結合部位となっている。微小管結合領域はアクチンとも結合でき、N末突起領域を介して、微小管とアクチンフィラメントの架橋をしている場合もある。MAP2とTauは主に神経系の細胞で発現しているが、神経細胞ではMAP2は主に樹状突起に、Tauは軸索に存在しており、それぞれの神経突起を区別するマーカーとしてよく使われている。MAP4は神経細胞以外の多くの組織や細胞でも発現している。特に増殖細胞での分裂間期と分裂期の微小管の動態(安定性)変化に大きく寄与していると考えられている。このファミリータンパクの微小管重合能はリン酸化によって制御されている。複数のプロテインキナーゼによってリン酸化され、リン酸化により微小管結合および重合能が低下する。特にTauのリン酸化はアルツハイマー病(Alzheimer's disease)で見られる神経原繊維変化(neurofibrillary tangle)の主要構成成分であることから注目をされている。また、Tau自身も前頭側頭葉型認知症(FTDP-17)の原因遺伝子であることが判っている。参考文献 |
| 植物の微小管 |
|---|
| 【microtubule in plants】 |
| 村田 隆 |
| 基礎生物学研究所 生物進化研究部門 |
| お問合せ |
植物細胞の微小管はその構築様式に特徴を持つ。第一の特徴は細胞周期の進行にともなって様々な構造を作ることである。間期の細胞では微小管は細胞膜に沿って並ぶ(表層微小管列、cortical array)。M期が近づくと、微小管は将来の分裂面に沿って帯状に集積する(分裂準備帯、preprophase band)。紡錘体の極は収束せず、樽状の紡錘体ができる。細胞質分裂で細胞板ができる時には、微小管は細胞板を分泌するフラグモプラスト(隔膜形成体、phragmoplast)をつくる。表層微小管列は緑藻を含む多くの緑色植物に見られるが、分裂準備帯は陸上植物の体細胞、フラグモプラストは陸上植物とその近縁の藻類にのみ見られる構造である。第二の特徴は、中心体を持たず、微小管形成が細胞内の様々な場所で起こることである。表層微小管列においては既存の微小管上で新しい微小管が形成されることがわかっている。中心体の喪失は陸上植物の体細胞に見られる現象で、多くの緑藻は中心体を持つ。参考文献 |
| 微小管マイナス端結合因子 |
|---|
| 【Microtubule minus-end binding proteins】 |
| 孟文 翔1・竹市 雅俊 2 |
| 1Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 2理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
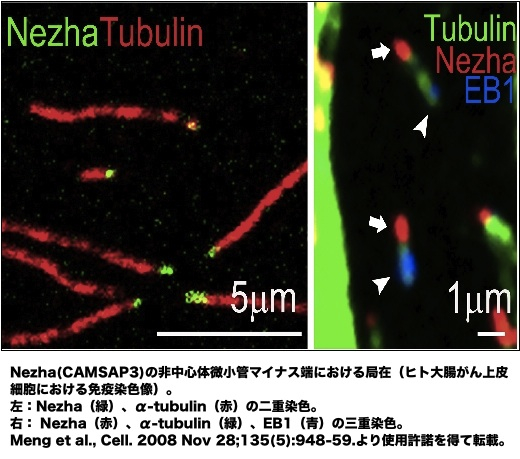
| 微小管は、プラス、マイナス両端において動的な構造体であるが、プラス端でチュ-ブリンの付加が起きやすい。この付加とマイナス端での解離がバランスされるとトレッドミル状態となることもあるが、マイナス端の脱重合速度はプラス端での重合速度よりも早いため、マイナス端が安定化されていなければ微小管は消滅する。しかし、マイナス端が何らかの形で安定化されると、微小管はブラス端だけで重合・脱重合を繰り返す[1, 2]。これが通常、細胞内でみられる微小管の状態である。 マイナス端の安定化は、中心体、またはそれ以外の細胞内構造(または分子)との結合によってもたらされ、それに対応して、微小管は中心体微小管、非中心体微小管とに分類される[2]。中心体では、γチューブリンがγ-チューブリン複合体蛋白質(γ-tubulin complex components, GCPs)と共にγチューブリン環複合体(γ-tubulin ring complex, γTuRC)を形成する。γTuRCは微小管マイナス端をキャップして安定化することで、プラス端における持続的な伸長/短縮ダイナミクスの繰り返しを可能とする。中心体は、さらに多数の成分を含み、微小管形成中心(microtubule organizing center, MTOC)としての役割を果たす[3-6]。哺乳類の細胞では、ninein、CEP192、CG-NAPとpericentrin などがγTuRCの機能を支え、これらの分子が欠損すると微小管の伸長が障害される[7-10]。 非中心体微小管は 上皮細胞、筋繊維、神経軸索等において顕著で、また、高等植物細胞はそもそも中心体を持たない。ゴルジ体、核膜、細胞膜等の構造体から非中心体微小管のプラス端重合が始まることが知られているが、その詳細な分子機構については未解明な部分が多い(繊毛微小管は、中心小体から成る基底小体から発するので、中心体微小管の一様式とみなすべきであろう)[2]。最近、微小管マイナス端結合因子Nezha(CAMSAP3)が同定され、非中心体微小管形成機構研究は新しい局面を迎えている。Nezhaは、接着結合(adherens junction, AJ)、及び、細胞質に分布し、微小管のマイナス端に結合してプラス端側の自由な伸長を支える(画像)。細胞接着部位では、Eカドヘリン-p120カテニン- PLEKHA7複合体にNezhaが結合することで微小管をAJにつなぎとめ、Nezha欠失によりAJが障害される[11, 12]。ショウジョウバエにはNezha 類似分子 Partronin(SSP4)があり、これが欠失すると細胞分裂時の紡錘体が縮小する。Partroninはマイナス端に結合することにより、キネシン13による微小管脱重合を阻害する[13, 14]。これは、Nezha/Patroninによる非中心体微小管の安定化機構をよく説明している。 またデスモソームにおいては、構成成分デスモプラキンに中心体から遊離したnineinが結合し、これが微小管をデスモソームにつなぎとめるという報告もあり、微小管マイナス端結合タンパク質が必要に応じて多様な細胞内構造に再配置される例が見つかってきている[15]。 参考文献1. Kollman, J.M., Merdes, A., Mourey, L., and Agard, D.A. Nature reviews Molecular cell biology 12:709-721 (2011)
2. Keating, T.J., and Borisy, G.G. Biol Cell 91:321-329 (1999) 3. Kollman, J.M., Polka, J.K., Zelter, A., Davis, T.N., and Agard, D.A. Nature 466:879-882 (2010) 4. Wiese, C., and Zheng, Y. Curr Opin Struct Biol 9:250-259 (1999) 5. Wiese, C., and Zheng, Y. Nat Cell Biol 2:358-364 (2000) 6. Murphy, S.M., Preble, A.M., Patel, U.K., O'Connell, K.L., Dias, D.P., Moritz, M., Agard, D., Stults, J.T., and Stearns, T. Mol Biol Cell 12:3340-3352 (2001) 7. Delgehyr, N., Sillibourne, J., and Bornens, M. J Cell Sci 118:1565-1575 (2005) 8. Gomez-Ferreria, M.A., Rath, U., Buster, D.W., Chanda, S.K., Caldwell, J.S., Rines, D.R., and Sharp, D.J. Curr Biol 17:1960-1966 (2007) 9. Takahashi, M., Yamagiwa, A., Nishimura, T., Mukai, H., and Ono, Y. Mol Biol Cell 13:3235-3245 (2002) 10. Zimmerman, W.C., Sillibourne, J., Rosa, J., and Doxsey, S.J. Mol Biol Cell 15:3642-3657 (2004) 11. Meng, W., Mushika, Y., Ichii, T., and Takeichi, M. Cell 135:948-959 (2008) 12. Akhmanova, A., and Yap, A.S. Cell 135:791-793 (2008) 13. Goodwin, S.S., and Vale, R.D. Cell 143:263-274 (2010) 14. Gardner, M.K., Zanic, M., Gell, C., Bormuth, V., and Howard. Cell 147:1092-1103 (2011) 15. Lechler, T., and Fuchs, E. J Cell Biol 176:147-154 (2007) |
| RNAの輸送 |
|---|
| 【RNA transport】 |
| 椎名 伸之 |
| 基礎生物学研究所・神経細胞生物学研究室 |
| お問合せ |
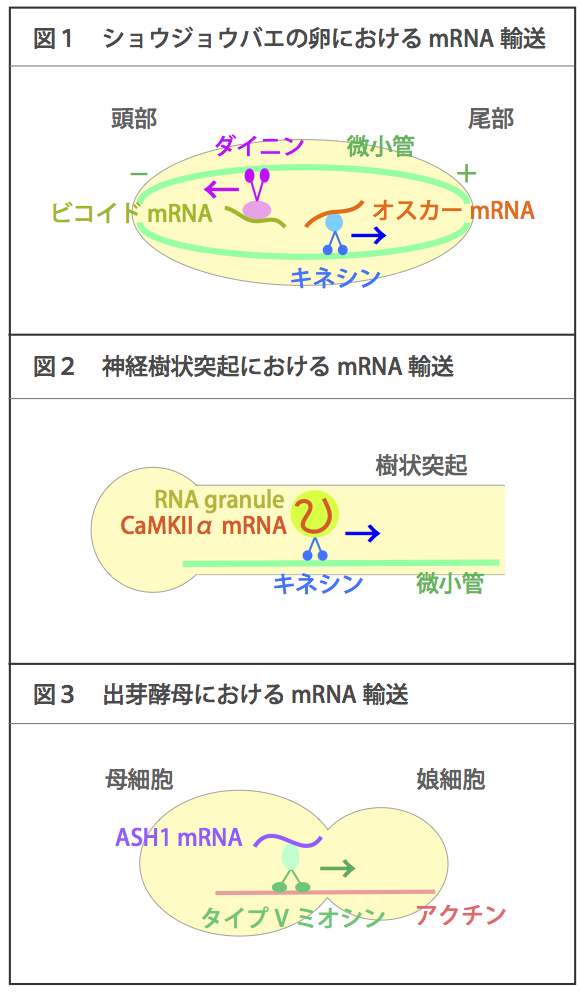
| 微小管やアクチン細胞骨格をレールとして、特定の種類のmRNAが輸送される。微小管をレールとした場合にはキネシンやダイニンをモータータンパク質として用い、アクチンをレールとした場合にはタイプVミオシンをモータータンパク質として用いることが知られている。mRNA輸送によって、細胞内の局所でタンパク質を合成して機能させることができる。 例えばショウジョウバエの卵では、微小管のマイナス端は頭部側を、プラス端は尾部側を向いて形成されている。ビコイドmRNAはダイニンによってマイナス端すなわち頭部側へ輸送され、オスカーmRNAはキネシンによってプラス端すなわち尾部側へ輸送される(図1)。頭部、尾部にそれぞれ係留されたmRNAから局所的にタンパク質が合成される結果、タンパク質局在に濃度勾配ができる。その濃度勾配は、頭部と尾部の体軸形成に必須である。 神経細胞の樹状突起では、カルモジュリンキナーゼIIα(CaMKIIα) mRNAなどが微小管をレールとしてキネシンによって輸送される。この際mRNAはRNA granuleと呼ばれる巨大複合体に取り込まれて輸送されることが知られている(図2)。mRNAはシナプス刺激入力に応じて局所的に翻訳され、局所シナプスの選択的な長期増強、ひいては記憶や学習に関与する。 また、出芽酵母では、ASH1 mRNAがアクチンをレールとしてタイプVミオシンによって母細胞から娘細胞へ輸送される(図3)。その結果、ASH1 mRNAおよび翻訳産物は娘細胞にのみ局在し、母細胞と娘細胞の運命(接合型)は異なったものになる。 参考文献 |
| アクチン重合 |
|---|
| 【actin polymerization】 |
| 渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
アクチンは筋肉の線維性タンパク質であるが、筋細胞以外のほとんどの真核細胞にも存在し、表層の細胞骨格ネットワークの主成分を成している。アクチンは単量体、もしくは、それが数珠状につながった線維のいずれかの状態で存在する。細胞が運動するときや外来の刺激に応答し変形する際、単量体アクチンが線維に変換するアクチン重合が盛んにおきる。アクチン重合は、線維を形成する重合核形成(nucleation)と線維端に単量体が次々と付加する伸長(elongation)の2つのステップに分けることができる。重合核形成のステップでは、単量体アクチンが2量体や3量体を形成しては解離することを繰り返すため、なかなか線維が形成されない。この重合核形成を促進する分子群として、Arp2/3複合体、フォルミンファミリータンパク質、SpireなどWH2ドメインをもつものが同定されてきた。これらの重合核形成促進因子は、Rhoファミリー低分子量Gタンパク質を中心とした細胞内情報伝達機構によって活性化される。アクチン伸長は、フォルミンファミリーやVASPによって維持、もしくは加速され、逆にキャッピングプロテイン、ゲルソリンなどによって阻害される。これらの機構により細胞内のアクチン重合のタイミングは調整され、細胞表層の構造をリモデリングするとともに、細胞先端の仮足では重合端を外側に向けながら細胞膜を押す力を発生する。参考文献 |
| フォルミンファミリータンパク質 |
|---|
| 【Formin homology proteins】 |
| 渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
フォルミンファミリータンパク質(以下、フォルミン)は、真核生物に広く存在するアクチン重合核形成促進因子である。哺乳類では〜15個、シロイヌナズナでは20余りの遺伝子が存在する。フォルミンの多くは、細胞質分裂、細胞極性形成に必須な遺伝子の産物である。マウスでは、Formin2の欠損で卵の減数分裂不全が、mDia1/3のダブルノックアウトで脳室下帯からの神経細胞の遊走の障害と、一部の個体において神経上皮の極性異常を伴った脳室周囲の異形成が生ずる。フォルミンは、C 末端側にフォルミン相同ドメイン1 と2(以下FH1,FH2)をもつ。FH1は、ポリプロリン配列の繰り返しからなり、FH2はフォルミンに特有のドメインで約400アミノ酸からなる。FH2はアクチン重合核形成作用をもつが、重合核形成後もアクチンの速い伸長端である反矢じり端(barbed end)にとどまり、連続的にアクチンを伸長させながら移動する、プロセッシブアクチン重合の性質をもつ。FH1は、複数のプロフィリン-アクチン複合体に結合することで、アクチン伸長を数倍に加速する。細胞内では、毎秒720個のアクチン単量体を取り込む速度で線維伸長することが、mDia1の細胞内分子可視化によって観察されている。参考文献 |
| プロフィリン |
|---|
| 【Profilin】 |
| 渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
12-15 kDのアクチンモノマー結合タンパク質。細胞質に豊富にある。単量体アクチンのADP-ATP交換反応を加速するとともに、ATP結合単量体アクチンに強く結合する(解離定数 〜0.1 μM)。プロフィリンに結合したアクチンは、速い重合端であるアクチン線維の反矢じり端(barbed end)に単量体アクチンと同様の速さで付加されるため、プロフィリンはアクチン伸長を助けるが、アクチン重合核の形成に対しては阻害的に働く。また、平衡状態のアクチン線維では脱重合端となる矢じり端(pointed end)への重合は阻害する。プロフィリン-アクチン複合体は、細胞質に10〜40 μM存在し、迅速な線維伸長を可能とする。また、アクチン伸長端に結合するフォルミンファミリータンパク質やEna/VASPタンパク質のポリプロリン配列に結合することで、協調して線維伸長を数倍加速する。インビトロでは、ADPアクチンの線維の反矢じり端からの脱重合を促進することも知られている。ホスファチジルイノシトール(4, 5)二リン酸などのホスホリピッドに結合するとアクチンとの相互作用が弱まる。参考文献 |
| トロポモジュリン |
|---|
| 【tropomodulin】 |
| 山城 佐和子・渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
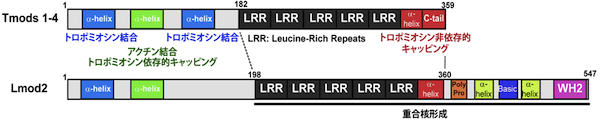
アクチン線維マイナス端 (矢じり端 または pointed end) キャッピングタンパク質。マイナス端に弱く結合する(解離定数= 約 0.1 μM)が、 アクチン結合タンパク質トロポミオシンにも結合し、トロポミオシンが結合したアクチン線維に対して強いキャッピング活性を示す(解離定数=約 0.2 nM)。海綿以後の多細胞生物で普遍的に存在し、酵母と植物では相同遺伝子は同定されていない。ほとんどの脊椎動物は4つの分子種(Tmod1-4) を持つ。生体内では、マイナス端キャッピング活性によりアクチン線維の安定性と長さを調節すると推測されており、心筋・骨格筋の筋原繊維形成、及び、赤血球・上皮細胞・レンズ繊維細胞のスペクトリン細胞膜骨格の形成と維持に関与する。ショウジョウバエ飛翔筋の筋原繊維と赤血球のスペクトリン細胞膜骨格では、アクチン繊維の長さ調節に関与する。培養細胞の細胞運動では、Tmod3 がラメリポディアに局在し、アクチン線維のダイナミックな再編成の調節に関与する。脊椎動物では、類縁のアクチン結合タンパク質にライオモディン (leiomodin, Lmod1-3) があり、N末端側のトロポモジュリン相同ドメインと、C末端側の アクチン結合WH2モチーフを含むドメインからなる (画像参照)。ライオモディンは強いアクチン重合核形成活性を持ち、この活性にはトロポモジュリン相同ドメインの一部 (leucine-rich repeats) とC末端側のドメインが必要である。横紋筋及び平滑筋に発現し、Lmod2 は筋原繊維形成に関与する。 参考文献Yamashiro S, Gokhin DS, Kimura S, Nowak RB and Fowler VM, Tropomodulins: pointed-end capping proteins that regulate actin filament architecture in diverse cell types. Cytoskeleton in press
Gokhin DS and Fowler VM, Tropomodulin capping of actin filaments in striate muscle development and physiology. J Biomed Biotechnol. 2011 Epub 2011 Oct 17. |
| 酵母の紡錘体微小管 |
|---|
| 【Spindle microtubules in yeast】 |
| 佐藤 政充 |
| 東京大学大学院理学系研究科生物化学専攻 |
| お問合せ |
| 紡錘体(スピンドル、spindle)は微小管(microtubule)の束が多数集まって構成される細胞内の構造である。真核細胞において紡錘体はゲノム染色体を2個の娘細胞に分配するために必要不可欠の役割を担う(「紡錘体微小管」の項を参照)。酵母における紡錘体微小管の基本的な機能や性質は高等生物のものと良く似ているが、相違点もいくつかある。 高等生物では一般的に紡錘体はひし形であるが、酵母では微小管が束ねられて直線状の形を示す(図参照)。また、酵母では分裂期でも核膜が崩壊しない(closed mitosisと呼ばれる)ため、紡錘体が核内に形成されるという大きな特徴がある(「酵母の核分裂」の項を参照)。 分裂酵母では、間期(interphase)に見られる細胞質の微小管構造は分裂期(mitosis)になると消失し、かわりに核内に紡錘体微小管を形成する(図参照)[1]。このように、細胞周期の時期に応じて、微小管の形成される場所が細胞質から核へと移る。その分子メカニズムはまだ明らかにされていないが、第一に微小管を安定化するタンパク質が核内に蓄積することが重要であり、第二に微小管を形成する原点であるスピンドル極体(SPB;「酵母の中心体」の項を参照)が分裂期に核膜に埋め込まれることが必要であると考えられる[2, 3]。 これに対して、出芽酵母のSPBは細胞周期を通して常に核膜に埋め込まれているため(「酵母の中心体」の項を参照)、間期でも核内にわずかながら微小管構造が存在し[4]、分裂期に突入する前のG2期の段階で紡錘体を形成する(図参照)。さらに出芽酵母では、出芽した娘細胞に核を正しく分配させるために、細胞質の微小管が細胞の内壁をたどっていき紡錘体を回転させ(spindle orientation、図参照)、核を娘細胞へと誘導する。 紡錘体微小管は、複製された染色体の動原体部位(キネトコア、kinetochore)を接着して両極に引っ張ることで染色体を分配する。微小管の接着が未完了の場合や、不適切な接着が起きた場合には、紡錘体形成チェックポイント(spindle assembly checkpoint)と呼ばれる監視機構が活性化して、すべての動原体が微小管によって正しく捕捉されるまで細胞周期を分裂中期(metaphase)に停止させる。Mad2やBub1などのチェックポイント因子は酵母からヒトまで真核細胞生物で幅広く保存されている。 参考文献 |
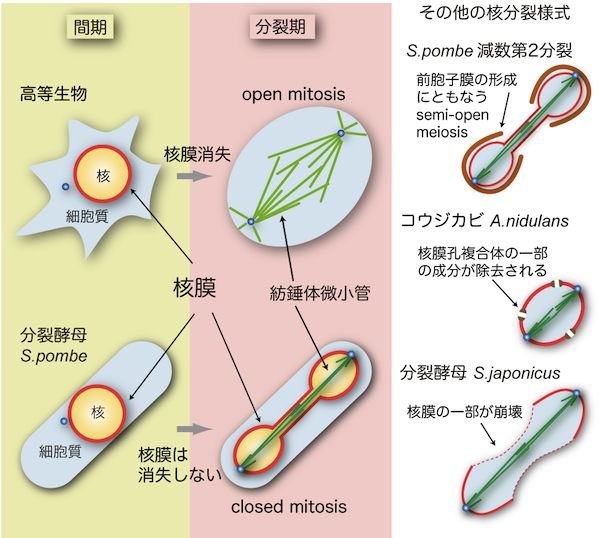
| 酵母の核分裂 |
|---|
| 【Closed mitosis: nuclear division in yeast】 |
| 新井 邦生・佐藤 政充 |
| 東京大学大学院理学系研究科生物化学専攻 |
| お問合せ |
| 酵母における細胞分裂は、基本的には高等生物の細胞分裂と類似しているが、分裂期に核膜が崩壊しないことが構造上の最も大きな違いである。
高等生物では、分裂期に核膜が消失する(nuclear envelope break down, NEBD)ため、その形態はopen mitosisと呼ばれる。酵母を含む多くの単細胞生物では分裂期でも核膜が崩壊せず、closed mitosisと呼ばれる(図参照)[1]。したがって、Ran GTPaseによって統括される核・細胞質間の物質輸送は分裂期にも機能する。紡錘体微小管は核内に形成される必要がある(「酵母の紡錘体微小管」「酵母の中心体」の項を参照)が、Ranが輸送する重要な積み荷として、紡錘体微小管の形成に重要な役割を果たすAlp7/TACC (transforming acidic coiled-coil)タンパク質が知られている[2]。分裂後期(anaphase)には、紡錘体微小管が伸長することで核膜が維持されたまま核が2個に分裂する。このように、体細胞分裂において核分裂をおこすためには紡錘体微小管の伸長が不可欠である。 酵母の核分裂はclosed mitosisのみだと長らく信じられてきた。しかし近年、分裂酵母S. pombeの減数第2分裂においては、核膜は崩壊しないものの、核・細胞質間を隔てる機能が失われることが分かった(semi-open meiosis, virtual open meiosisと呼ぶ;図参照)[3,4]。減数第2分裂では配偶子(胞子)を作るために、核膜のまわりに前胞子膜(forespore membrane)と呼ばれる膜を形成する。前胞子膜が形成されることで、核膜あるいは核膜孔複合体(nuclear pore complex)にも連動して影響が生じている可能性がある。 コウジカビA. nidulansは分裂期に核膜孔複合体の一部の成分が除去されることで核・細胞質間の隔たりが無効化されるsemi-open mitosisをおこなう[5]。また、S. pombe近縁種の分裂酵母S. japonicusでは、体細胞分裂時に核膜の一部が崩壊することが分かった(図参照)[6]。このように、酵母やカビに限っても核分裂には様々な様式があることが明らかになってきた。それぞれの様式にどのような利点があるのかは推測の域を出ないが、各生物の生態に密接に関連した様式の核分裂をおこなっているのかもしれない。 参考文献 |
| 酵母の中心体:スピンドル極体 |
|---|
| 【SPB: spindle pole body】 |
| 戸谷 美夏 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
| 酵母は、動物細胞における中心体に相当する細胞内小器官として、スピンドル極体 (SPBと呼ばれることが多い)をもつ。SPBは、直径約100nm程度の円盤が重なったような、中心体とは大きく異なる構造をもつが、中心体と同様に、細胞内で微小管形成中心(MTOC: microtubule organizing center)として働いている(図参照)。SPBと中心体には、微小管の形成起点となるγチューブリン複合体 (γ-tubulin complex) が局在する。それ以外にも、SPBと中心体を構成する因子には、互いに機能的な相同性をもつタンパク質が多く含まれる。 細胞分裂時には、 SPBは、 スピンドル微小管(高等生物の紡錘体:「酵母の紡錘体微小管」の項を参照)の形成起点として両極に存在し、微小管のマイナス端を繋ぎ止めて、精確な染色体の分配に貢献している。細胞分裂により母娘細胞に分配されたSPBは、1細胞周期に1回だけの複製を行って、細胞内での数を保っている。 酵母では、細胞分裂期にも核膜が消失しないため、SPBは、核膜に埋め込まれて、核内にスピンドル微小管を形成する(「酵母の核分裂」の項を参照)。 出芽酵母のSPBは、 複製されたばかりの新しいSPBが一過的に核膜の外に観察されるが、すぐに核膜に埋め込まれ、 その後は細胞周期を通して核膜に埋め込まれて存在する。分裂酵母のSPBは、分裂期にのみ核膜に埋め込まれて核内にスピンドル微小管を形成する。間期には、核膜に添うように細胞質側に存在し、細胞質微小管のMTOCのひとつとして働いている。 減数分裂では、染色体組換えの時期に、核内の微小管がSPBによってひとつに束ねられる。分裂酵母では、SPBが先頭になって核を引っ張りまわすように動き、相同染色体の効率的な組換えを可能にしている(「酵母の微小管」の項を参照)。 SPBと中心体は、MTOCとしての働きのほかにも、情報伝達分子の足場としての役割をもつ。分裂期に重要な複数のキナーゼが、 SPB・中心体に局在することが知られている。分裂酵母では隔壁形成を制御する分子群(SIN: septation initiation network)、出芽酵母では分裂期脱出を制御する分子群 (MEN: mitosis exit network)なども、SPBに局在する。複製されたSPBが等価ではない(成熟度の違いによってOldとNewの区別が生じる)ことを利用した、非対称や極性の制御に関わるしくみの存在が示唆される。細胞分裂に非対称性を与えることも、SPB・中心体の重要な役割であると考えられる。 参考文献 |
| リポソームと細胞骨格(アクチン、微小管、セプチン) |
|---|
| 【Reconstruction of cytoskeletons (actin, microtubule or septin) using liposome】 |
| 滝口 金吾・滝口 陽子 |
| 名古屋大学大学院理学研究科 |
| お問合せ |
| 生体膜の形態形成や動態制御の機構をインビトロの系で研究する際、膜のモデルとして巨大人工脂質膜小胞(巨大リポソーム、giant liposome、giant vesicleまたはgiant unilamellar vesicleなど)がよく使われる。巨大リポソームは、脂質二重膜(lipid bilayer、脂質二分子膜など色々な呼び方がある)が水溶液中で自然に閉じてできる人工膜小胞(liposome またはvesicle)の中でも直径がμmオーダー以上のものをそのように呼ぶ [1, 2]。細胞と同程度の大きさであり、位相差、蛍光、微分干渉、暗視野などいろいろな光学顕微鏡法で直接観察ができる利点を持つ。 巨大リポソームの作製には、試験管内に作製したリン脂質を主成分とする脂質フィルムに水溶液を加え静置して得る静置水和法(gentle hydration、natural swellingなど)や [3-5]、白金や透明導電ガラス(ITO (indium tin oxide)ガラスが多く用いられる)の表面にリン脂質を主成分とする脂質を塗布しておき、水溶液中で交流電圧を印加して作るエレクトロフォーメーション法(electro formation)が主流である [6]。最近は、界面通過法(spontaneous transfer)など、油水界面にできる脂質の単層の膜(lipid monolayer、これも脂質一分子膜など色々な呼び方がある。単層の脂質二重膜との混同に注意!)を利用して作製する新たなリポソーム作製法も開発され、より広汎な条件下、より良い効率で巨大リポソームが得られるようになってきている [7, 8]。 細胞骨格と生体膜との相互作用を見る目的で、アクチンや微小管、セプチンなどを巨大リポソームに再構成させる場合には2通りある。 1つは、巨大リポソーム内に細胞骨格蛋白質を封入し、リポソーム内部の空間で再構成させる方法である。静置水和法やエレクトロフォーメーション法でリポソームを作製する際に、重合前のG-アクチンやチューブリンを含んだ水溶液を使うと、自然に内部にG-アクチンやチューブリンを取り込んだ巨大リポソームが形成されてくる。このリポソームの形成後に温度の上昇や塩の内部供給によって、リポソームの内部でアクチン線維や微小管の重合を起こさせることができる [3, 4, 9]。また界面通過法などの手法を用いれば、既に重合してできたアクチン線維やアクチンの束もリポソーム内部に再構成することが可能である [7, 8]。 もう1つは、予め作製しておいた巨大リポソームを含む溶液に、灌流装置を用いて細胞骨格蛋白質溶液を添加することにより、リポソームの外部から相互作用させ、その表面で再構成させる方法である。セプチンの膜結合能の検証および膜突起誘導活性の発見は、この方法によって成された [5]。 リポソームの作製は容易で観察法も様々あるので、膜の研究を行う際に大変有効である。しかし、巨大リポソームに限らず、リポソームを用いて実験しようとするときには以下のことに留意する必要がある。リポソームの作製にどのような手法を用いるにしても、脂質組成や作製時の温度、溶液条件が、作製効率ならびに作製されてくるリポソームのサイズや形態に大きく影響する。特に作製時に使う水溶液が2価の陽イオンや高濃度の塩を含む場合、多層の脂質二重膜からできた膜小胞(multilamellar vesicle)や、脂質二重膜を形成仕損なった脂質分子が凝集してできた油滴(lipid droplet)などが形成されてくるので、リポソームとの混同に注意しなければならない。生理的な塩濃度など高い塩濃度条件下でリポソームを使用したり作製したりするためには、先ず等張の糖を含む溶液で作製しておいたリポソームを実験に使う、脂質組成にPEG(polyethylene glycol)を結合させた脂質を加えて作製する、界面通過法などのような手法を用いてリポソームを作製する、などの工夫が必要である [5-9]。 参考文献[1] R. Lipowsky, Nature 349, 475-481 (1991)
[2] H. Hotani et al., Biosystems 71, 93-100 (2003) [3] M. Honda et al., J. Mol. Boil. 287, 293-300 (1999) [4] T. Kaneko et al., J. Mol. Boil. 284, 1671-1681 (1998) [5] Y. Tanaka-Takiguchi et al., Curr. Biol. 19, 140-145 (2009) [6] T. Wollert & J.H. Hurley, Nature 464, 864-869 (2010) [7] K. Takiguchi et al., Langmuir 27, 11528-11535 (2011) [8] K. Takiguchi et al., Methods Enzymol. 464, 31-53 (2009) [9] L. Limozin et al., Phys. Rev. Lett. 95, 178101 (2005) |
| 紡錘体形成 |
|---|
| 【Spindle assembly】 |
| 五島 剛太 |
| 名古屋大学大学院理学研究科生命理学専攻 |
| お問合せ |
紡錘体(スピンドル:spindle)は細胞分裂の際に形成される双極性(bipolar)の構造体であり、細胞分裂装置(mitotic apparatus)と呼ぶこともある。染色体を娘細胞へと分配し、細胞質分裂を制御するために必須の役割を果たす。主要構成因子はチューブリン(tubulin)の重合体である微小管(microtubule)、および、さまざまな微小管結合蛋白質(microtubule-associated protein: MAP)である。動物体細胞においては2つの中心体(centrosome)が主な微小管形成中心(microtubule organising centre: MTOC)となり、中心体から伸びた微小管が凝縮した染色体を捕捉する。一方、植物細胞や減数分裂期の動物細胞の一部には中心体が存在せず、別のメカニズムにより紡錘体微小管が生み出されている。これまでに、染色体自身が微小管の形成を誘導することや(Ran GTPアーゼやAurora Bキナーゼが関わる)、既存の微小管に依存して新たに微小管が生み出される微小管増幅経路(オーグミン複合体が関与する)の存在が明らかにされた。また、動物体細胞においてもこうした経路が中心体経路と同時に働いていることも明らかになった。参考文献 |
| 微小管の重合核形成 |
|---|
| 【Microtubule nucleation】 |
| 五島 剛太 |
| 名古屋大学大学院理学研究科生命理学専攻 |
| お問合せ |
| 微小管(microtubule)はチューブリン(tubulin)の重合体である。試験管内では高濃度のチューブリンとGTPを混ぜると重合反応が起きて微小管が容易に生み出されるが、細胞内では通常、チューブリンは高濃度では存在せず、偶発的な重合反応が起こることは稀である。重合の際に律速となっているのは最初の段階(=重合核の形成)である。いったんチューブリンの重合が開始されると(=重合核が形成されると)、チューブリンは低濃度でも効率よく次々と付加されて微小管は伸長する。微小管の重合核形成因子としては、γチューブリン複合体(γ-tubulin complex)が知られている。試験管内でγチューブリン複合体と低濃度のチューブリンを混ぜると微小管は効率よく生み出される。細胞内では、たとえばγチューブリン複合体が多く集積している中心体では、絶え間なく微小管が生み出されている。一方、細胞内に存在するγチューブリン複合体の大半を除去してもなお一部の微小管は作り出されることから、γチューブリン複合体とは別の重合核形成因子(nucleator)が存在することも示唆されている。 なお、筆者は「重合核形成」という言葉を用いているが、「nucleation」に対する日本語訳は定まっていない。実際の日常会話では日本語でもたいていそのまま「Nucleation(ヌクリエーション)」と言っている。 参考文献 |
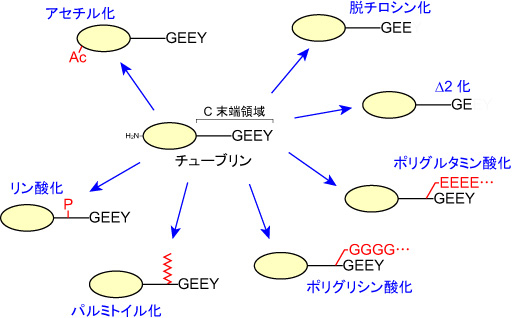
| チューブリンの翻訳後修飾 |
|---|
| 【Post-translational modifications of tubulin】 |
| 池上 浩司 |
| 浜松医科大学 医学部 解剖学講座 |
| お問合せ |
チューブリン(tubulin)は、アセチル化(acetylation)、リン酸化(phosphorylation)、パルミトイル化(palmitoylation)、脱チロシン化(detyrosination)、Δ2化、ポリグルタミン酸化(poly-glutamylation)、ポリグリシン化(polyglycylation)などの翻訳後修飾を受ける。アセチル化以外の修飾は、微小管(microtubule)表面に位置するチューブリンC末端領域に集中し、微小管表面の多様性を生み出す。修飾による微小管表面の多様性は、微小管と微小管結合タンパク質(MAPs)との相互作用に強い影響を与え、微小管の安定性や分子モーターの移動先などを制御する。参考文献 |
| Arp2/3複合体とアクチン重合 |
|---|
| 【Arp2/3 complex and actin polymerization】 |
| 千住 洋介・末次 志郎 |
| 東京大学 分子細胞生物学研究所 細胞形態研究分野 |
| お問合せ |
Arp2/3複合体は、二つのアクチン関連タンパク質 (actin-related protein) Arp2とArp3を含むヘテロ七量体のタンパク質複合体である。サブユニットのArp2とArp3は、ATP結合ポケットを持ち、単量体アクチン (G-actin) に似た構造を持つ。Arp2/3複合体は細胞に見られる枝分かれしたアクチン繊維の枝(branch)の基部に存在し、試験管内でも枝分かれしたアクチン繊維を形成することができる。この枝分かれ形成機構については、当初二つの説、end branchingおよびside branching、があったが、現在ではおおむね次のようなside branchingモデルに収束している。アクチンのみで行われるアクチン重合においては、単量体アクチンの3量体形成が重合核となる。したがって、Arp2/3複合体はアクチン重合に必要な重合核形成の段階で、単量体アクチンが形成する3量体のうち、2分子部分を代替すると考えられている。不活性化状態では、Arp2とArp3の配向はアクチン重合に適した方向ではないが、Arp2/3複合体とその活性化タンパク質との結合は、Arp2とArp3の配向をアクチン重合に適した方向に変える。代表的なArp2/3複合体の活性化タンパク質は、WASPファミリータンパク質であり、WASPファミリータンパク質のVCAドメインがArp2/3の活性化を担う。VCAドメインは、Arp2とArp3の配向を調節するだけでなく、3量体形成に必要な残り一つの単量体アクチンにも結合し、結合した単量体アクチンをArp2/3複合体に供給することでアクチン重合を活性化する。活性化したArp2/3複合体は、既に形成されているアクチン繊維 (F-actin) の側面に結合しつつ、アクチン重合を誘導し、アクチン繊維の枝分かれ構造を形成する【画像1】。このような枝分かれしたアクチン繊維の形成は、ラメリポディア形成やクラスリン被覆小胞のエンドサイトーシス等において重要であると考えられている。参考文献 |
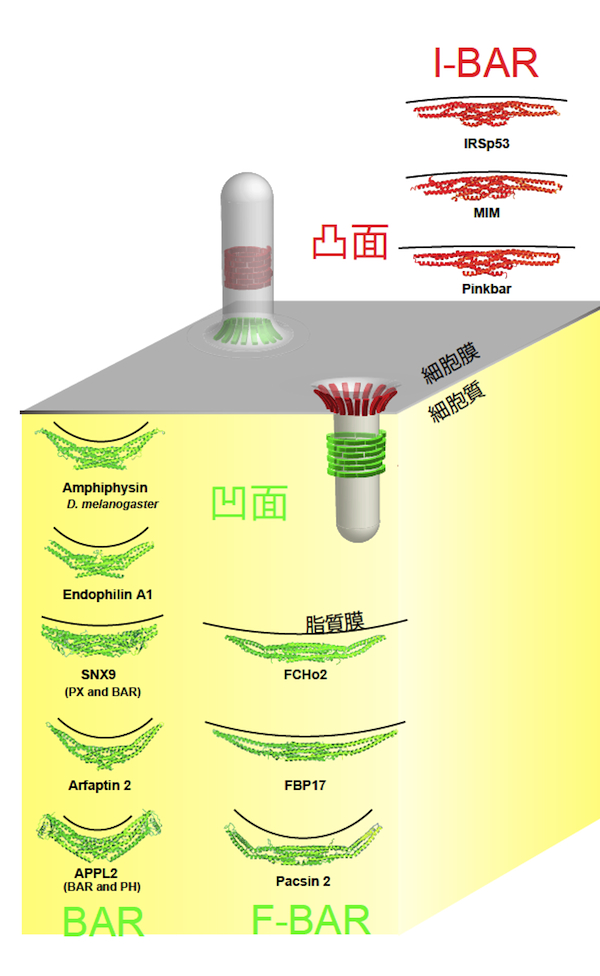
| BAR ドメイン |
|---|
| 【BAR domain】 |
| 千住 洋介・末次 志郎 |
| 東京大学 分子細胞生物学研究所 細胞形態研究分野 |
| お問合せ |
BAR (Bin/Amphiphysin/Rvs) ドメインスーパーファミリーは、BARドメインと総称される、BARドメイン、F-BARドメイン、I-BARドメインのサブファミリーに分類されるドメインを持つ。BARドメインおよびF-BARドメインは、三日月形の二量体を形成し、負に帯電している細胞膜と静電的な相互作用で結合する【画像1】。BARドメインとF-BARドメインは、三日月型二量体の立体構造における凹面が正に帯電している。この結合様式は、細胞膜の陥入構造に対応すると考えられ、実際に、多くのBARドメイン含有タンパク質 (Amphiphysin やEndophilinなど) や、F-BARドメイン含有タンパク質 (FBP17やFCHo1など) は、エンドサイトーシスなどの細胞膜の陥入構造の形成に関与する。一方、IRSp53等に含まれるI-BARドメインは、凸面が正に帯電している。よって、陥入構造とは逆の形態である、フィロポディアなどの細胞膜の突起構造の形成に関与する。また、BARドメイン、F-BARドメイン、I-BARドメインの中には、両親媒性ヘリックスなどの脂質膜に挿入されると考えられる部位を持つものがあり、この部位の挿入は、細胞膜の曲率形成を促進する。全体として、BARドメインスーパーファミリーは、細胞膜の曲率を認識、あるいは生成する機能を有すると考えられている。多くのBARドメイン含有タンパク質は、SH3ドメイン等の他のドメインを伴う。このため、BARドメイン含有タンパク質は、膜の曲率に準拠して、タンパク質を集積させる可能性がある。代表的なSH3ドメイン結合タンパク質は、Arp2/3複合体を活性化するWASPファミリータンパク質や、細胞膜を切断するダイナミン (dynamin) である。参考文献 |
| 細胞分裂軸 |
|---|
| 【Cell division axis】 |
| 豊島 文子 |
| 京都大学ウイルス研究所 細胞生物学研究部門 構造形成学研究分野 |
| お問合せ |
| 細胞が分裂する方向のことであり、細胞分裂面と垂直に交わる軸方向を指す。細胞分裂軸は分裂期紡錘体の両極を結ぶ線と平行であるため、紡錘体軸の方向によって分裂軸が決定される。紡錘体軸は多くの場合、分裂中期に決定されるが、幾つかの組織・細胞では分裂後期に軸方向が変化するとの報告もある。
紡錘体軸の方向は「細胞の形」「細胞極性」「細胞―細胞間接着」「細胞ー細胞外基質接着」などの細胞内外の要因によって決定される。細胞は、周囲の環境や細胞の分化過程によって、これらの要因を使い分けている。そのため、紡錘体軸を決める分子機構は細胞や組織の種類によって異なる。進化的に保存されている紡錘体軸制御因子としてGα-LGN-NuMA複合体が広く知られている。しかし、全ての場合においてこの複合体が主要因子として機能するわけではないので、注意が必要である。 参考文献生化学 84, 81-91, 2012 |
| セプチン |
|---|
| 【Septin】 |
| 上谷 大介・木下 専 |
| 名古屋大学大学院理学研究科 生命理学専攻 情報機構学講座 |
| お問合せ |
セプチンは細胞質分裂(septation)・細胞極性・細胞形態の異常を呈する出芽酵母変異体の責任蛋白質として同定された重合性GTP結合蛋白質とそのホモログの総称である。セプチンファミリーはRas様のGTP/GDP結合領域をコアドメインとして共有し、多くはカルボキシル側にコイルドコイル配列を持つ。セプチン遺伝子は菌類からヒトまでの真核生物で進化的に保存され、出芽酵母では7種類、線虫では2種類、ショウジョウバエでは5種類、マウスでは13種類、ヒトでは14種類存在するが植物には存在しない。セプチンは多様な組み合わせでフィラメント状ヘテロオリゴマーを形成し、さらに環状線維束を形成したり人工リン脂質膜上で2次元格子を形成するなど独特の高次集合性を持つ。セプチンを主成分とする環状構造体としては出芽酵母の分裂溝直下に形成されるセプチン・リング(septin ring)がよく研究されてきた。セプチン・リングは細胞周期進行および細胞質分裂関連分子を集積させる足場(scaffold)としての役割と、細胞膜および内膜系上を流動する膜蛋白質の非対称性分布を保つ拡散障壁(diffusion barrier)として母-娘細胞を区画化する役割を持つことが報告されている。細胞質分裂の分子機構は種間・系譜間の多様性が著しく、セプチン・リングが明確に同定できない場合も多いが、セプチンの要求性は種を超えて保存されている。多細胞生物におけるセプチンの発現はむしろ分裂後の細胞に多いため、細胞質分裂以外の機能に興味が持たれている。哺乳類においては、精子鞭毛内(輪状小体)と繊毛基部の細胞膜直下にセプチンを主成分とすると推測される環状構造体が存在し、足場・拡散障壁機能以外に細胞表層剛性維持機能を持つことが示されている。哺乳類のセプチンの一部は非筋型ミオシンと相互作用することにより、アクトミオシンを主成分とする収縮輪やアクチンストレス線維(actin stress fiber)の維持に寄与するが、詳細は不明である。ヒトでは優性変異型SEPT9 が家族性神経痛性筋萎縮症の原因となるほか、パーキンソン病、統合失調症、精子無力症では複数のセプチンの量的・質的異常が随伴する。参考文献木下 専 蛋白質 核酸 酵素 54, 1150-1158 (2009)
Weirich CS, Erzberger JP, Barral Y. The septin family of GTPases: architecture and dynamics.Nat Rev Mol Cell Biol. 9(6):478-89, 2008. |
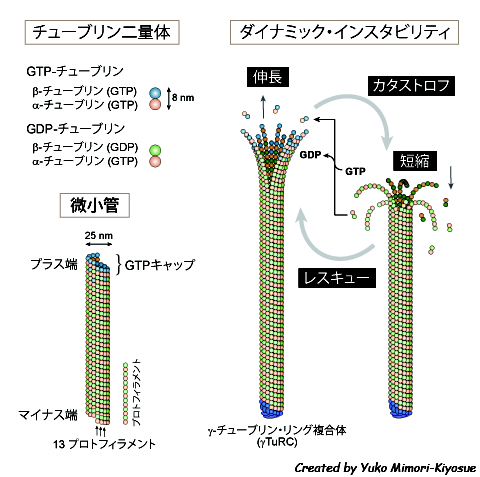
| 微小管のダイナミック・インスタビリティ |
|---|
| 【Dynamic instability of microtubules】 |
| 清末 優子 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
| 微小管は、α-チューブリンとβ-チューブリンのヘテロ二量体が重合して形成される、直径25 nmの筒状のフィラメントである(図)。α-/β-チューブリン二量体が同じ向きに長軸方向に共有結合してプロトフィラメントが形成され、13本のプロトフィラメントが側面で結合して微小管となる。微小管の伸長が早い端をプラス端、反対側をマイナス端とよび、プラス端先端にはβ-チューブリンが位置している。α-チューブリンとβ-チューブリンはそれぞれグアニンヌクレオチド結合部位を1個所もち、α-チューブリンは常にGTPを結合しているが、β-チューブリンのGTPは重合すると加水分解されてGDPとなり、脱重合してフリーになるとGDPが溶液中のGTPに交換されるというサイクルを繰り返している。GTPの加水分解はチューブリンの重合には必要ないが、GDP-チューブリンはフィラメントの外側に向けて反り返った構造をとり、脱重合しやすくなるため、フィラメントの速やかな崩壊をもたらす[1]。重合直後のまだGTPを保持しているチューブリンからなる先端部分は“GTPキャップ”とよばれ、脱重合を抑止して持続的な微小管伸長を助ける[2]。 個々の微小管の挙動を観察すると、精製タンパク質を用いたin vitro再構成系においても、細胞内においても、比較的ゆっくりとした伸長と、伸長よりも数倍早い速度での急速な短縮を繰り返している。この挙動はin vitroにおいても特にプラス端側で活発であるが、細胞内ではマイナス端側は安定化因子によってキャップされていることが多く非動的なため(「微小管マイナス端結合因子」の稿参照)、伸縮の繰り返しは主にプラス端側においてのみ観察される。フィラメントの端で自発的な重合と脱重合の相転換を起こすという性質は、細胞骨格ポリマーの中でも微小管に特徴的なもので、ダイナミック・インスタビリティ(動的不安定性)とよばれている[3, 4]。ダイナミック・インスタビリティのパラメータは、微小管の伸長(growth)と短縮(shrink)、伸長から短縮への変換をカタストロフ(catastrophe)、短縮から伸長への変換をレスキュー(rescue)で表す(図)。伸縮がない状態をポーズ(pause)とよぶが、チューブリンの重合・脱重合が全く生じないという状況はほとんど起こらないので、伸縮の繰り返しの距離が検出限界以下の状態ともいえる。また、系全体のダイナミクスさの程度を表す指標として、カタストロフとレスキューの頻度の総和としてダイナミシティ(dynamicity)という言葉で表すこともある。 このような動的な性質は、微小管ネットワークのパターンを必要に応じて速やかに再編するために役立つ[5]。細胞の中では、様々な因子がダイナミック・インスタビリティを調節し、微小管の長さや配置を時空間的に制御している(「古典的MAPs」「微小管不安定化因子」「微小管切断因子」「微小管の重合核形成」「微小管プラス端集積因子(+TIPs)」の稿参照)。微小管再編の最も顕著な例は、細胞分裂開始時、間期微小管が完全に崩壊して分裂期紡錘体が形成される劇的な過程であろう。間期においても、細胞構造に応じた多様な配置をとって、オルガネラの配置や物質輸送を担い、秩序だった細胞活動の基盤となっている。 参考文献1. Elie-Caille, C. et al. Straight GDP-tubulin protofilaments form in the presence of taxol. Current Biology 17, 1765-1770 (2007). 2. Howard, J. & Hyman, A.A. Growth, fluctuation and switching at microtubule plus ends. Nature Reviews Molecular Cell Biology 10, 569-574 (2009). 3. Hotani, H. & Horio, T. Dynamics of microtubules visualized by darkfield microscopy: treadmilling and dynamic instability. Cell Motil Cytoskeleton 10, 229-236 (1988). 4. Mitchison, T. & Kirschner, M. Dynamic instability of microtubule growth. Nature 312, 237-242 (1984). 5. Kirschner, M. & Mitchison, T. Beyond self-assembly: from microtubules to morphogenesis. Cell 45, 329-342 (1986). |
| 微小管プラス端集積因子(+TIPs) |
|---|
| 【Microtubule plus-end-tracking proteins (+TIPs)】 |
| 清末 優子 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
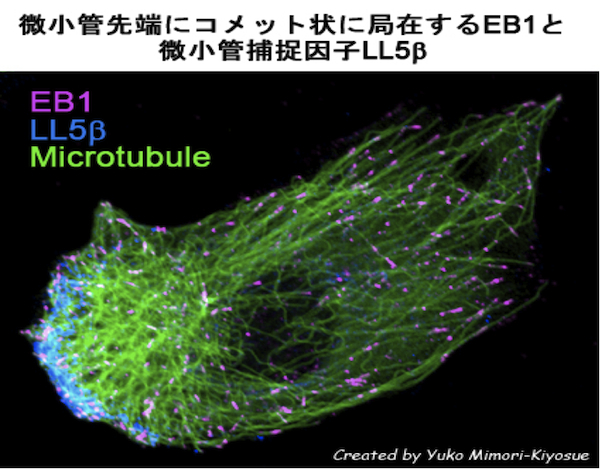
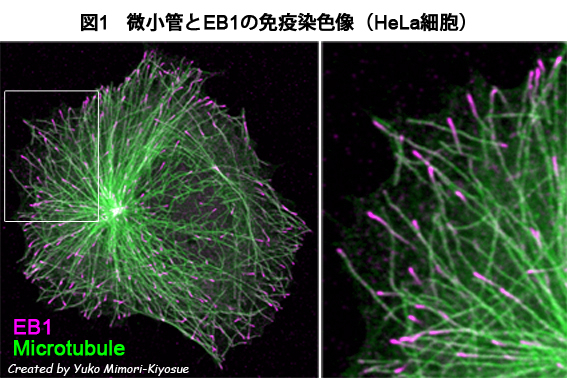
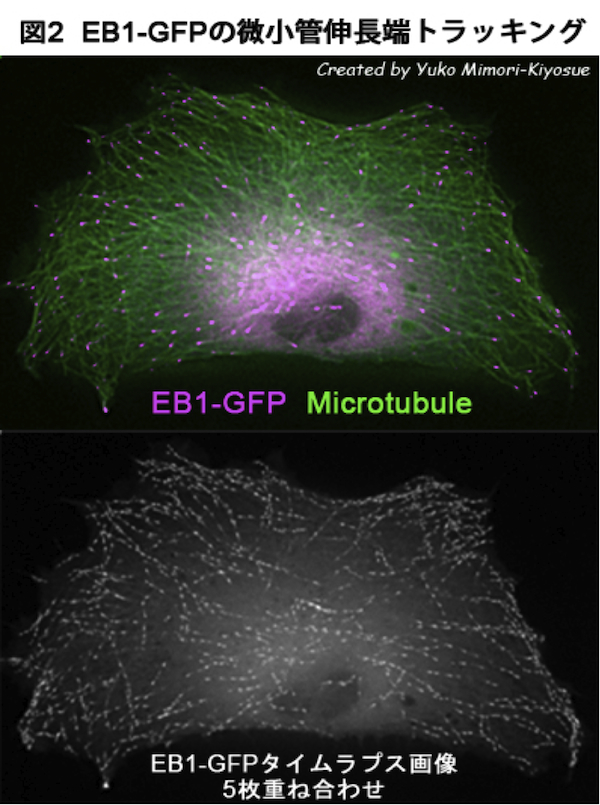
| EB1ファミリー・タンパク質 |
|---|
| 【EB1 family proteins】 |
| 清末 優子 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
| TRIOBP |
|---|
| 【TRIOBP】 |
| 北尻 真一郎 |
| 京都大学医学部附属病院耳鼻咽喉科 |
| お問合せ |
| 有毛細胞と難聴 |
|---|
| 【Hair cell and deafness 】 |
| 北尻 真一郎 |
| 京都大学医学部附属病院耳鼻咽喉科 |
| お問合せ |
| 音などによる振動を電気信号に変換し、神経へ伝える細胞を有毛細胞という。哺乳類、両生類、鳥類、魚類といった脊椎動物全般に加えて、昆虫類にも存在する。以下は哺乳類の音受容に関して述べる。
音は空気の振動であり、これは耳の穴(外耳道)から入って鼓膜を振動させる。鼓膜の振動は耳小骨を経て、内耳へと伝えられる。内耳はリンパ液で満たされており、ここに有毛細胞が存在する。有毛細胞の表面(アピカル面)には不動毛と呼ばれる毛が生えており、音によりリンパ液が振動すると有毛細胞は脱分極する。これは一種のメカノトランスダクションである(本用語集を参照)。有毛細胞は聴神経とシナプスを形成しており、音刺激で生じた脱分極でのシグナルは脳へと伝えられて、音として認知される。 このいずれの箇所が障害されても難聴の原因となるが、音を感知する上での鍵となる構造は有毛細胞の不動毛と考えられている。不動毛を構成する細胞骨格はアクチン繊維の束であり、その意味で上皮細胞の微絨毛や培養細胞のフィロポディアと相同性が高い。不動毛には細胞質へ伸びる根が存在し、これもアクチン束で構成されている。この根が欠損すると不動毛の剛性が下がり、軽い振動刺激でも大きく揺れて変性してしまう。不動毛は音を感知するために揺れ動かなければならないが、根はその機械的ストレスから不動毛や有毛細胞を守っていると考えられる。 この根の知見はTRIOBP(本用語集「TRIOBP」の稿を参照)の解析から得られたものであるが、その端緒はヒト遺伝性難聴家系からTRIOBP遺伝子変異が同定されたことによる。有毛細胞で機能しているミオシン、カドヘリン、プロトカドヘリンなどの分子の大多数は、同様にヒト難聴者のゲノム解析で見出されてきた。聴覚には各分子の厳密な制御が必要なため、他の臓器では異常をきたさないような変異でも難聴をきたすことや、難聴は致死的疾患ではないため、ヒト難聴家系が多く存在するのである。 音という物理的振動を、周波数(音の高さ)や振幅(音の強さ)情報を含めて、しかもミリ秒単位での時間的変化に対応して感知するためには、有毛細胞の形態および神経など周囲の細胞との連携が厳密に制御される必要がある。有毛細胞は上皮細胞としての性格を有し、細胞間接着が非常に発達しているとともに、不動毛の形態は平面内細胞極性(planar cell polarity)を顕著に示す。同時にシナプスを有し、神経系のモデルともなる。有毛細胞で発現している分子の多くは内耳以外にも発現しており、有毛細胞は幅広い生命現象のモデルとして活用できる。 参考文献Frolenkov GI, Belyantseva IA, Friedman TB, Griffith AJ. (2004) Nat Rev Genet 5:489-498.
Kitajiri S, Sakamoto T, Belyantseva IA, Goodyear RJ, Stepanyan R, Fujiwara I, Bird JE, Riazuddin S, Riazuddin S, Ahmed ZM, Hinshaw JE, Sellers J, Bartles JR, Hammer JA 3rd, Richardson GP, Griffith AJ, Frolenkov GI, Friedman TB. (2010) Cell 141:786-798. |

 HOME
HOME