- ホーム
- >
- 細胞生物学用語集トップ
- >
- 新着細胞生物学用語集()
新着細胞生物学用語集()
| メカノトランスダクション |
|---|
| 【mechanotransduction】 |
| 米村 重信 |
| 理化学研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
機械的刺激(情報)を生化学的シグナルに変換すること。関連する言葉のメカノセンシング(mechanosensing)は機械的刺激を知覚することで、分子レベルでは、機械的刺激によって分子が構造変化を起こすことに対応する。メカノレスポンス(mechanoresponse)は機械的刺激から生体の反応(メカノトランスダクション以降に起こる、細胞骨格の変化や遺伝子発現など)が起こること。メカノトランスダクションは構造変化を起こした分子が、生化学的シグナルを引き起こす段階である。この場合の生化学的シグナルには、チャンネルの開閉、酵素活性の制御、タンパク質との結合などが含まれる。参考文献 |
| アクチン繊維によるメカノセンシング |
|---|
| 【Mechanosensing by actin filaments】 |
| 上田 太郎 |
| 産業技術総合研究所 バイオメディカル研究部門 |
| お問合せ |
| アクチン繊維は弾性をもった二重らせんであり、引っ張ればわずかに長くなる[1,2,3]。Shimozawaら[4]は、蛍光標識したアクチンの蛍光強度がin vitroの張力負荷によって変化することを見出しているし、Matsushitaら[5]は、分子動力学シミュレーションにより、張力負荷がアクチン繊維の長さとらせんピッチ両方を伸ばすことを報告している。したがって張力負荷されたアクチン繊維の長さとらせんピッチがばねのように伸びることは間違いない。しかしこのことが直ちにアクチン繊維がメカノセンサーであることを意味するわけではない。アクチン繊維がメカノセンサーとして機能するためには、張力負荷によりアクチン繊維としての機能が変化し、何らかのシグナル伝達の起点になければならないからである。しかしアクチン繊維は弾性係数が大きく(バネとして固い)、生理的な張力負荷で伸びる割合が小さい(0.3%程度)ため、これがシグナル伝達の起点になるという考えは一般的ではなかった。
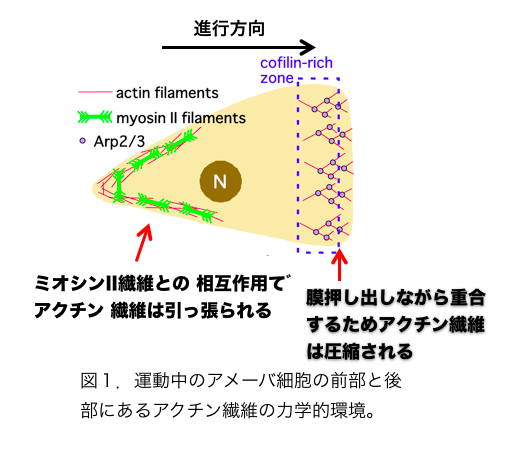
こうした状況にあって、2011年にアクチン繊維はメカノセンサーであることを示す論文が2報、わが国の研究者から発表された。論文発表は同じ2011年でも学会発表が先行していたという意味で第一にあげるべきは、名古屋大の早川、辰巳、曽我部らによる、コフィリンとアクチン繊維の相互作用に関する論文である[6]。彼らはin vitroの実験で、コフィリンは張力のかかったアクチン繊維と結合しにくく、また切断しにくいことを発見し、さらにセミインタクトおよびインタクトなhuman umbilical vein endothelial cells (HUVECs)において、コフィリンが張力のかかっていないストレスファイバーと選択的に結合することも示した。張力のかかっていないストレスファイバーが崩壊しやすいことは以前から知られており、アクチン繊維のメカノセンシングに依存したコフィリン活性がこの現象に関与すると示唆されたわけである。もう一つの例は張力に依存したアクチン繊維とS1(ミオシンIIのモータードメイン)の結合である[7]。これはもっぱら生きた細胞性粘菌細胞を用いた観察で、GFP−S1が張力がかかっている細胞内アクチン繊維と優先的に結合することを報告ている。この現象は、S1にアクチンとの親和性を高める変異が必要であること、またミオシンIIとアクチン繊維の相互作用を調節することが知られている既知のタンパク質に依存しないことなどから、張力のかかったアクチン繊維に特徴的な構造をS1が直接認識して優先的に結合したと解釈された。興味深いことに、ミオシンIIのS1は張力負荷アクチン繊維と優先的に結合したが、ミオシンIのモータードメインはそうした選択性を示さなかった。この現象は、ミオシンIIは本来、細胞後部でフィラメントを形成してアクチン繊維と相互作用し、張力を発生させるのに対し、ミオシンIは細胞前部に局在して張力発生には関与しないことと関連があるのかもしれない。現在のところ、アクチン繊維のメカノセンシングが関与することが示唆されているのは、コフィリンおよびミオシンIIとアクチン繊維の相互作用だけであるが、アクチン繊維の構造が張力負荷で変化するなら、他のアクチン結合タンパク質との相互作用もアクチン繊維のメカノセンシングにより様々な調節を受けていると推測される。 アクチン系細胞骨格と相互作用するメカノセンサーはすでにいくつか知られている[8,9,10,11,12]。一方、アクチン繊維は非常に多数の因子と相互作用する多機能構造であり、かつ細胞表層全体に張り巡らされたネットワークであるため、アクチン繊維自体がメカノセンサーであることには、細胞全体の活性をコーディネートしうるという意味で大きな生理的意義をもちうる。こうした観点から議論しておきたいことは、アクチン繊維の構造多型と機能分化の関連である。そもそもアクチン繊維が単体で構造的多型性をもつという概念はE.H.Egelmanらの電子顕微鏡観察によりかなり以前から提唱されていた[13,14,15] (ただし最近のFujiiらの電子顕微鏡観察[16]はアクチン繊維の構造多型性に否定的であり、決着はついていない)が、その生理的意義は不明確であった。しかしコフィリンを初めとする種々のアクチン結合タンパク質の結合が、アクチンサブユニットの構造を変化させることが明らかとなり[17]、これがアクチン結合タンパク質とアクチン繊維の結合が協同的であることの構造的基盤であると提唱され[18]、アクチン繊維の構造多型の生理的意義がおぼろげながら見えてきた。つまり、たとえばコフィリンがアクチン繊維のあるサブユニットに結合すると、そのサブユニットの構造が「コフィリン結合型」に変化し、さらにこの構造変化が隣接するサブユニットの構造もコフィリン結合型に変化させる(協同的構造変化)と、その隣接サブユニットとコフィリンの親和性が増加し、結果的にコフィリンのクラスターが形成される(協同的結合)という考え方である。一方、ミオシンIIがアクチン繊維に結合すると、張力とは無関係にアクチン繊維のらせんピッチがわずかに延びることが報告されており[19]、またHMM(ミオシンIIの可溶性断片)は、微量のATP存在下でアクチン繊維と協同的に結合することも報告されている[20]ので、ミオシンIIモーターとアクチン繊維の協同的相互作用にもコフィリンの場合と同様、アクチン繊維の協同的構造変化が関与する可能性がある。ただしらせんピッチの伸び縮みの方向が逆なので、コフィリン結合によるアクチン繊維の協同的構造変化と、ミオシンII結合によるアクチン繊維の協同的構造変化はまったく異なったものであろう。この仮想的メカニズムには、細胞内のアクチン繊維の機能分化を安定化させる作用が期待でき、大変魅力的である(図1,2)。 参考文献1. Kojima H, Ishijima A, Yanagida T (1994) Proc Natl Acad Sci U S A 91: 12962-12966.
2. Huxley HE, Stewart A, Sosa H, Irving T (1994) Biophys J 67: 2411-2421 3. Wakabayashi K, Sugimoto Y, Tanaka H, Ueno Y, Takezawa Y, et al. (1994) Biophys J 67: 2422-2435. 4. Shimozawa T, Ishiwata S (2009) Biophys J 96: 1036-1044. 5. Matsushita S, Inoue Y, Hojo M, Sokabe M, Adachi T (2011) J Biomech 44: 1776-1781. 6. Hayakawa K, Tatsumi H, Sokabe M (2011) J Cell Biol 195: 721-727. 7. Uyeda TQ, Iwadate Y, Umeki N, Nagasaki A, Yumura S PLoS One 6: e26200. 8. Yonemura S, Wada Y, Watanabe T, Nagafuchi A, Shibata M (2010) Nat Cell Biol 12: 533-542. 9. Sawada Y, Tamada M, Dubin-Thaler BJ, Cherniavskaya O, Sakai R, et al. (2006) Cell 127: 1015-1026. 10. Kee YS, Robinson DN (2008) Curr Biol 18: R860-862. 11. Pramanik MK, Iijima M, Iwadate Y, Yumura S (2009) Genes Cells 14: 821-834. 12. del Rio A, Perez-Jimenez R, Liu R, Roca-Cusachs P, Fernandez JM, et al. (2009) Science 323: 638-641. 13. Egelman EH, Francis N, DeRosier DJ (1982) Nature 298: 131-135. 14. Galkin VE, Orlova A, Schroder GF, Egelman EH (2010) Nat Struct Mol Biol 17: 1318-1323. 15. Orlova A, Prochniewicz E, Egelman EH (1995) J Mol Biol 245: 598-607. 16. Fujii T, Iwane AH, Yanagida T, Namba K (2010) Nature 467: 724-728. 17. Galkin VE, Orlova A, Lukoyanova N, Wriggers W, Egelman EH (2001) J Cell Biol 153: 75-86. 18. Ressad F, Didry D, Xia GX, Hong Y, Chua NH, et al. (1998) J Biol Chem 273: 20894-20902. 19. Tsaturyan AK, Koubassova N, Ferenczi MA, Narayanan T, Roessle M, et al. (2005) Biophys J 88: 1902-1910. 20. Tokuraku K, Kurogi R, Toya R, Uyeda TQP (2008) J Mol Biol 386: 149-162. |
| 有毛細胞と難聴 |
|---|
| 【Hair cell and deafness 】 |
| 北尻 真一郎 |
| 京都大学医学部附属病院耳鼻咽喉科 |
| お問合せ |
| 音などによる振動を電気信号に変換し、神経へ伝える細胞を有毛細胞という。哺乳類、両生類、鳥類、魚類といった脊椎動物全般に加えて、昆虫類にも存在する。以下は哺乳類の音受容に関して述べる。
音は空気の振動であり、これは耳の穴(外耳道)から入って鼓膜を振動させる。鼓膜の振動は耳小骨を経て、内耳へと伝えられる。内耳はリンパ液で満たされており、ここに有毛細胞が存在する。有毛細胞の表面(アピカル面)には不動毛と呼ばれる毛が生えており、音によりリンパ液が振動すると有毛細胞は脱分極する。これは一種のメカノトランスダクションである(本用語集を参照)。有毛細胞は聴神経とシナプスを形成しており、音刺激で生じた脱分極でのシグナルは脳へと伝えられて、音として認知される。 このいずれの箇所が障害されても難聴の原因となるが、音を感知する上での鍵となる構造は有毛細胞の不動毛と考えられている。不動毛を構成する細胞骨格はアクチン繊維の束であり、その意味で上皮細胞の微絨毛や培養細胞のフィロポディアと相同性が高い。不動毛には細胞質へ伸びる根が存在し、これもアクチン束で構成されている。この根が欠損すると不動毛の剛性が下がり、軽い振動刺激でも大きく揺れて変性してしまう。不動毛は音を感知するために揺れ動かなければならないが、根はその機械的ストレスから不動毛や有毛細胞を守っていると考えられる。 この根の知見はTRIOBP(本用語集「TRIOBP」の稿を参照)の解析から得られたものであるが、その端緒はヒト遺伝性難聴家系からTRIOBP遺伝子変異が同定されたことによる。有毛細胞で機能しているミオシン、カドヘリン、プロトカドヘリンなどの分子の大多数は、同様にヒト難聴者のゲノム解析で見出されてきた。聴覚には各分子の厳密な制御が必要なため、他の臓器では異常をきたさないような変異でも難聴をきたすことや、難聴は致死的疾患ではないため、ヒト難聴家系が多く存在するのである。 音という物理的振動を、周波数(音の高さ)や振幅(音の強さ)情報を含めて、しかもミリ秒単位での時間的変化に対応して感知するためには、有毛細胞の形態および神経など周囲の細胞との連携が厳密に制御される必要がある。有毛細胞は上皮細胞としての性格を有し、細胞間接着が非常に発達しているとともに、不動毛の形態は平面内細胞極性(planar cell polarity)を顕著に示す。同時にシナプスを有し、神経系のモデルともなる。有毛細胞で発現している分子の多くは内耳以外にも発現しており、有毛細胞は幅広い生命現象のモデルとして活用できる。 参考文献Frolenkov GI, Belyantseva IA, Friedman TB, Griffith AJ. (2004) Nat Rev Genet 5:489-498.
Kitajiri S, Sakamoto T, Belyantseva IA, Goodyear RJ, Stepanyan R, Fujiwara I, Bird JE, Riazuddin S, Riazuddin S, Ahmed ZM, Hinshaw JE, Sellers J, Bartles JR, Hammer JA 3rd, Richardson GP, Griffith AJ, Frolenkov GI, Friedman TB. (2010) Cell 141:786-798. |

 HOME
HOME