- ホーム
- >
- 細胞生物学用語集トップ
- >
- 新着細胞生物学用語集(中間径フィラメント)
新着細胞生物学用語集(中間径フィラメント)
| 中間径フィラメント(中間径繊維) |
|---|
| 【Intermediate filaments (IFs)】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
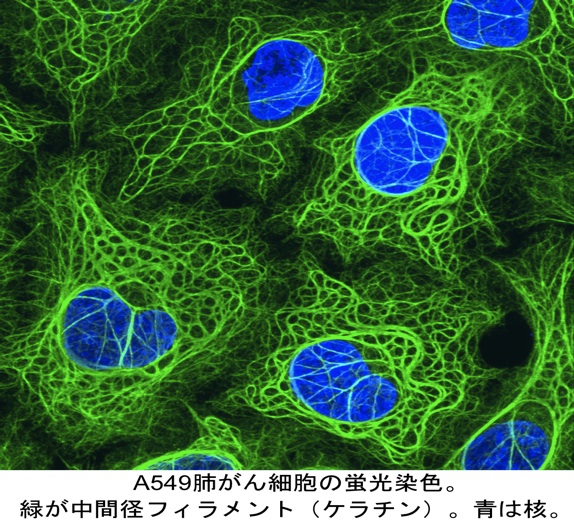
| 中間径フィラメント(fig1)は、アクチン繊維、微小管とならび細胞骨格を構成する主要3繊維の一つである。その名は、筋組織の電子顕微鏡観察においてミオシンIIの太いフィラメントとアクチンの細いフィラメントの中間の太さを示したことに由来するが(石川春律博士ら、文献1)、その太さ(10nm)はアクチン繊維と微小管の中間でもある。特徴として、これら3つの繊維の中では生化学的に最も溶けにくく、物理的には最も引っ張りに強い。そのため、細胞に機械的強度を付与していると考えられ、このことは変異動物や遺伝学の解析結果からも裏付けられている(教科書1, 2; 総説1; 以下同様)。
このような強い繊維構造は構成蛋白質同士が重合することによって構築される。その種類は複数あり、それぞれの相同性も互換性も低いが、構造的な類似によってフィラメント自体は同じサイズの似た性質となる。つまり、基本構造は長い棒状ドメイン(rod)とそれを挟む頭部(head)・尾部(tail)からなり、また重合に寄与する配列には保存性がある。 中間径フィラメントの種類についてみると、無脊椎動物にも類縁は存在するが少ない。一方、高等脊椎動物は中間径フィラメント構成蛋白質の種類が最も多く複雑である。それらは6つのグループに分けられ、重合できるグループは決まっている。さらにその発現に厳密な組織特異性が見られる。すなわち、ケラチン(keratin)は上皮細胞に、ビメンチン(vimentin)は結合組織細胞に、デスミン(desmin)は筋細胞に、GFAP (glial fibrillary acidic protein)はグリア細胞にそれぞれ発現する。 この特性は、医学領域においては腫瘍の分化マーカーとして利用されている。これを細胞生物学的に詳しく見れば、上皮の中間径フィラメントとしてのケラチンの特異性は高いが、そのサブタイプは20を超える。また、神経、筋、結合組織ではビメンチンをはじめ重なり合って発現する他の蛋白質がいくつかある。この冗長性が、中間径フィラメントの機能解析を困難にしている。 しかし近年の実験技術や遺伝子工学の進展により、各中間径フィラメントに特異的に結合する蛋白質が同定されるようになってきた。その中には、細胞種特異的な機能とよく相関を示すものがある(総説1, 2; 文献2, 3, 3', 4, 4'; 中間径フィラメント結合蛋白質の項も参照)。このことから、中間径フィラメントはこれら結合蛋白質にとっての足場(scaffold)でもあり、高等脊椎動物にみられる細胞種特異的な発現は、それぞれの細胞特性の付与に貢献しているのではないかと考えられるようになり、新たな注目を集めている。 参考文献文献1) Ishikawa H, Bischoff R, Holtzer H. J Cell Biol. 1968 Sep;38(3):538-55.
文献2) Kim S, Wong P, Coulombe PA. Nature. 2006 May 18;441(7091):362-5. 文献3) Sugimoto M, Inoko A, et al. J Cell Biol. 2008 Oct 6;183(1):19-28. 文献3') "Research Highlight" Nat Rev Mol Cell Biol. 2008 Nov;9:825 文献4) Inoko A, Matsuyama M, et al. J Cell Biol. 2012 Apr 30;197(3):391-405. 文献4') "In Focus: Trichoplein keeps primary cilia silent" J Cell Biol. 2012 Apr 30;197(3):341. 教科書1) 細胞の分子生物学 第5版 第16章 細胞骨格, NEWTON PRESS 教科書2) ルーイン細胞生物学 第4部 細胞骨格 9 中間径フィラメント, 東京化学同人 総説1) Fuchs E, Cleveland DW. Science. 1998 Jan 23;279(5350):514-9. 総説2) Coulombe PA, Wong P. Nat Cell Biol. 2004 Aug;6(8):699-706. |
| 中間径フィラメントのリン酸化による構築制御 |
|---|
| 【Role of phosphorylation on the disassembly of IFs】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
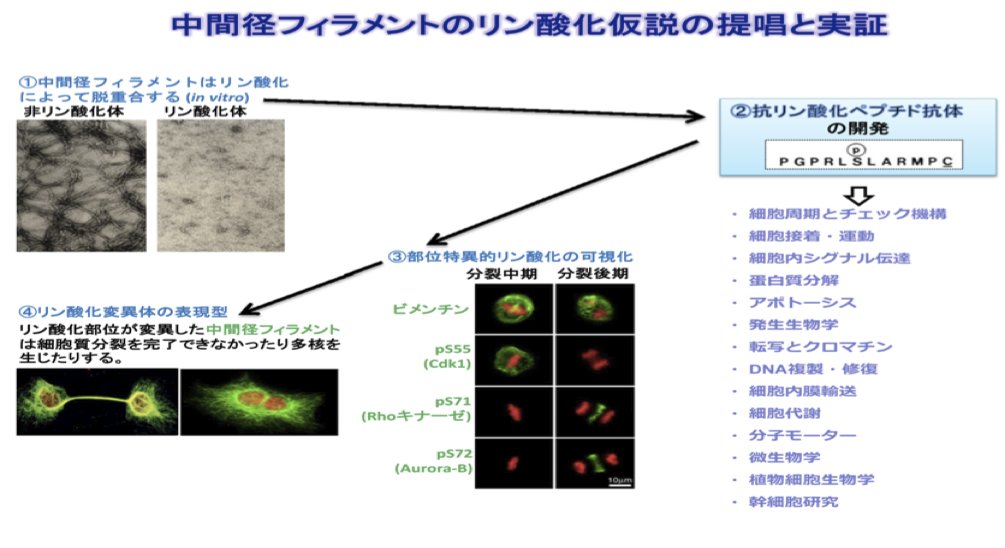
| 中間径フィラメント(中間径繊維と同義)はリン酸化により脱重合する。つまり、アクチン繊維や微小管と違い、基本的に濃度に依らない構築制御を受ける。そもそも中間径フィラメントは、非常に安定な不溶性の静的構造物と見なされていたため(中間径フィラメントの項を参照)、構築制御機構についての分子レベルでの理解は遅れていた。しかし1987年、稲垣昌樹博士ら(リンク1, 2)の報告により、中間径フィラメントの繊維構造がキナーゼによるリン酸化を受けて脱重合することがin vitroのビメンチン(vimentin)を用いた実験により明らかになった(fig1(1), 文献1)。この発見は、中間径フィラメントを動的な構造物として捉えなおす転機となり、従来の概念を変えたとされる。
この脱重合は細胞内現象として確認される必要があったため、アミノ酸残基のリン酸化を部位特異的に認識する抗体すなわち「抗リン酸化ペプチド抗体 (site- and phosphorylation state-specific antibody)」が同グループにより開発され、その作成から応用までが方法論として確立された(fig1(2), プロトコール1-3)。これらを用いた免疫染色により、ビメンチンが細胞分裂時に受ける複数の部位特異的リン酸化が可視化され、またそれぞれに特異的なキナーゼ(Cdk1, Rho-kinase, Aurora-B)が同定された(fig1(3); 総説1, 2)。さらにこのリン酸化部位を欠陥変異で置き換えると細胞質分裂が完了できなくなることを確認し(fig1(4))、このリン酸化による構築制御仮説は細胞現象、特に細胞分裂との関わりで実証された。 今、この方法論は細胞周期制御における重要なキナーゼカスケードの同定にも貢献している(fig1(2), 総説3)。 今後、このようなリン酸化変異体の影響を個体レベルで検討することが期待され、その研究は新展開を見せつつある。 参考文献リンク1) 愛知県がんセンター研究所・発がん制御研究部(稲垣昌樹研究室)
リンク2) 名古屋大学グローバルCOEプログラム 文献1) Inagaki M, Nishi Y, Nishizawa K, Matsuyama M, Sato C. Nature. 1987 Aug 13-19;328(6131):649-52. 総説1) Izawa I, Inagaki M. Cancer Sci. 2006 Mar;97(3):167-74. 総説2) 猪子誠人・後藤英仁, 中間径フィラメントの構築制御機構と細胞内機能, 細胞骨格と接着・蛋白質核酸酵素・2006年5月号増刊 (貝淵弘三・稲垣昌樹・佐邊壽孝・松崎文雄 編), 51, 551-558, 2006 総説3) 後藤英仁・稲垣昌樹, G2/M移行期におけるCDK1の活性化およびチェックポイント解除機構, 細胞周期フロンティア (佐方功幸・稲垣昌樹・岸本健雄 編),52-57, 共立出版, 2010 プロトコール1) Goto H, Inagaki M. Nat Protoc. 2007;2(10):2574-81. プロトコール2) 大海忍・辻村邦夫・稲垣昌樹 著, 抗ペプチド抗体実験プロトコール 新版, 秀潤社, 2004 プロトコール3) 後藤英仁・稲垣昌樹, Close Up実験法, 実験医学, 26, 2965-2972, 2008 |
| 中間径フィラメント結合蛋白質 |
|---|
| 【IF-associated proteins】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
| 中間径フィラメント(中間径繊維と同義)に結合する蛋白質。アクチン繊維や微小管の結合蛋白質と同様、繊維構造の安定化や架橋をすることで調節的に働くものがある一方で、やや趣を異にするものがある。それは細胞種固有の機能に大きく関与するものである(総説1-5)。
例えば、ケラチン(keratin)は上皮特異的な中間径フィラメントである(中間径フィラメントの項を参照)が、実はアポトーシス(apoptosis)に関わる蛋白質を結合させることで、そのシグナルの減弱に寄与している(文献1)。また、ケラチン17(keratin17)は創傷など増殖状態にある表皮で発現するケラチンであるが、これが14-3-3σを結合させて、蛋白質の生合成を促進させていることが明らかとなっている(文献2)。また、アルバトロス(Albatross)は上皮細胞の極性化に寄与する新規蛋白質であるが、ケラチンはこの蛋白質に結合し、これを安定化することで上皮分化に促進的に働くことが示された(文献3, 3')。 このように、中間径フィラメントが足場(scaffold)となることで、細胞種固有の機能に貢献していることがわかってきた。つまり、中間径フィラメント構成蛋白質が顕著な組織特異的発現を示すのには意味があると思われる。特にケラチンはがんの発生母地である上皮に特異的に発現しているため、結合蛋白質の同定により上皮機能との関与を新たに探す試みは、対極にあるがん化の新規メカニズムの発見にもつながることから、医学的にも重要であると思われる(リンク1, 2)。 参考文献総説1) Fuchs E, Cleveland DW. Science. 1998 Jan 23;279(5350):514-9.
総説2) Coulombe PA, Wong P. Nat Cell Biol. 2004 Aug;6(8):699-706. 総説3) Izawa I, Inagaki M. Cancer Sci. 2006 Mar;97(3):167-74. 総説4) 井澤一郎・稲垣昌樹, 中間径フィラメントの構築制御とシグナルクロストーク, 形と運動を司る細胞のダイナミクス・実験医学・2006増刊 (竹縄忠臣・遠藤剛 編), 58-63 総説5) 猪子誠人・後藤英仁, 中間径フィラメントの構築制御機構と細胞内機能, 細胞骨格と接着・蛋白質核酸酵素・2006年5月号増刊 (貝淵弘三・稲垣昌樹・佐邊壽孝・松崎文雄 編), 51, 551-558, 2006 文献1) Inada H, Izawa I, Nishizawa M, Fujita E, Kiyono T, Takahashi T, Momoi T, Inagaki M. J Cell Biol. 2001 Oct 29;155(3):415-26. 文献2) Kim S, Wong P, Coulombe PA. Nature. 2006 May 18;441(7091):362-5. 文献3) Sugimoto M, Inoko A, et al. J Cell Biol. 2008 Oct 6;183(1):19-28. 文献3') "Research Highlight" Nat Rev Mol Cell Biol. 2008 Nov;9:825 リンク1) 愛知県がんセンター研究所・発がん制御研究部(稲垣昌樹研究室) リンク2) 名古屋大学グローバルCOEプログラム |

 HOME
HOME