- ホーム
- >
- 細胞生物学用語集トップ
- >
- 新着細胞生物学用語集(微小管)
新着細胞生物学用語集(微小管)
| 微小管不安定化因子 |
|---|
| 【Microtubule Destabilizer】 |
| 岡田 康志 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| 微小管(microtubule)は動的なポリマーで、その構成タンパクであるα/β チューブリン(tubulin)のヘテロ二量体の重合と解離により伸長(growth)と短縮(catastrophe)を繰り返す(動的非平衡性dynamic instability)。細胞内には、多数の伸長を促進する因子と短縮を促進する因子の双方が存在しており、組織や細胞あるいは細胞周期などに応じて微小管のダイナミクスが調節されている。このうち前者を微小管安定化因子(microtubule stabilizer)、後者を微小管不安定化因子(microtubule destabilizer)あるいは微小管崩壊因子(microtubule catastrophe factor)と総称している。
これまで3種類の異なるタイプの微小管不安定化因子が知られている。 1つは、微小管をその途中で切断する酵素で、微小管切断因子(microtubule severing factor)と呼ばれている。カタニン(katanin, 日本語の刀にちなんで名付けられた)がその代表である。 2つめのタイプは、微小管の端に局在し、端からの脱重合を促進する酵素で、微小管脱重合因子(microtubule depolymerizing factor)と呼ばれている。モータータンパク質(motor protein)のキネシン(kinesin)の一種であるkinesin-13 (M型キネシン、マウスのKIF2やヒトのMCAKなど)や、kinesin-8 (出芽酵母のKip3 など)が代表である。 3つめのタイプは、チューブリン二量体に高い親和性で結合することで微小管の重合脱重合の動的平衡を脱重合側へ移動する蛋白(チューブリン隔離因子, tubulin sequestering factor)で、スタスミン(stathmin, OP18)が代表である。ただし、結晶構造の比較などから、スタスミンもkinesin-13と同様の微小管端での脱重合促進活性を持つと考えられている。 また、微小管の重合を阻害する薬剤のコルヒチン(colchicine)やノコダゾール(nocodazole)なども、微小管不安定化因子と呼ばれることがある。 参考文献 |
| 微小管切断因子 |
|---|
| 【Microtubule Severing Factor】 |
| 岡田 康志 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| 微小管切断因子(microtubule severing factor)とは、微小管を中途で切断する活性を持つ酵素である。椎名らの実験により細胞周期依存的な微小管切断活性の存在が示唆され、現在までに4種類の微小管切断酵素が同定されている。このうちEF1α以外の3種の蛋白は、膜輸送に関わるAAA蛋白VPS4と類縁で、katanin, spastin, fidgetin と名付けられている。このうちkataninは、分裂期細胞質中の微小管切断活性因子として同定され、日本語の刀に因んで命名された。Spastinおよびfidgetinは、それぞれ神経系の変異であるヒトの遺伝性痙性対麻痺(hereditary spastic paraplegia)およびマウスの自然変異体であるfidget(モジモジするという意味)の原因遺伝子として同定され、それぞれin vitroあるいはin vivoでの微小管切断活性が確認された。 変異体の解析により、これらの微小管切断因子は、細胞分裂における微小管の長さ・量の制御や、植物細胞の間期微小管の枝分かれ構造の形成・維持、線毛の調節、神経細胞での微小管の制御などの多様な機能を果たしていることが知られている。 VPS4自体には微小管切断活性は報告されていないが、リング状の12量体を形成して膜輸送蛋白複合体を解体する機能が知られている。リング状の6量体を形成するKataninやSpastinも、これと同様の機構で微小管を解体・切断すると提唱されている。 参考文献 |
| 古典的MAPs |
|---|
| 【Classical Microtubule-Associated Proteins】 |
| 久永 眞市 |
| 首都大学東京 / 大学院・理工学研究科 |
| お問合せ |
微小管(microtubule)を組織(主に哺乳動物の脳)や細胞から、重合・脱重合を繰り返して単離した時に、微小管を構成するチューブリン(tubulin)とともに取れてくるタンパク質で、微小管の重合や安定化活性をもつ因子。最初に見つかった微小管結合タンパク質(MAP)のため、古典的(classical)と呼ばれている。また、酵素活性など持たず、微小管壁に結合して、微小管間の距離を調節することから、構造的(Structural)MAPとも呼ばれることもある。MAP1ファミリーとMAP2/MAP4/Tauファミリーからなる。MAP1ファミリーにはMAP1A、MAP1B、MAP1Sがある。MAP1AとMAP1Bは主に神経細胞で発現し、MAP1Bは発達期の神経細胞で特に軸索(axon)に存在し、MAP1Aは成熟した脳の神経細胞の樹状突起(dendrite)に存在する。MAP1Sは多くの組織で発現している。いずれのMAP1も全長が翻訳された後、C末側の微小管に結合できる部分(軽鎖)が切断され、残りのN末側(重鎖)と複合体を形成して微小管に結合する。MAP1の軽鎖としてLC3も知られているが、これは最近オートファジー(autophagy)に関連する因子であることが判明している。MAP1は微小管安定化能を持つが、後述のMAP2よりは弱い。アクチンフィラメント(actin filament)にも結合できる。MAP2/MAP4/Tauファミリーは熱安定性で、特定の構造をもたない繊維状のタンパク質である。C末側に3-5つの微小管結合配列からなる微小管結合領域を持つ。N末側は微小管の外へ伸び出し、微小管間の距離を規定したり、他のタンパク質の結合部位となっている。微小管結合領域はアクチンとも結合でき、N末突起領域を介して、微小管とアクチンフィラメントの架橋をしている場合もある。MAP2とTauは主に神経系の細胞で発現しているが、神経細胞ではMAP2は主に樹状突起に、Tauは軸索に存在しており、それぞれの神経突起を区別するマーカーとしてよく使われている。MAP4は神経細胞以外の多くの組織や細胞でも発現している。特に増殖細胞での分裂間期と分裂期の微小管の動態(安定性)変化に大きく寄与していると考えられている。このファミリータンパクの微小管重合能はリン酸化によって制御されている。複数のプロテインキナーゼによってリン酸化され、リン酸化により微小管結合および重合能が低下する。特にTauのリン酸化はアルツハイマー病(Alzheimer's disease)で見られる神経原繊維変化(neurofibrillary tangle)の主要構成成分であることから注目をされている。また、Tau自身も前頭側頭葉型認知症(FTDP-17)の原因遺伝子であることが判っている。参考文献 |
| 植物の微小管 |
|---|
| 【microtubule in plants】 |
| 村田 隆 |
| 基礎生物学研究所 生物進化研究部門 |
| お問合せ |
植物細胞の微小管はその構築様式に特徴を持つ。第一の特徴は細胞周期の進行にともなって様々な構造を作ることである。間期の細胞では微小管は細胞膜に沿って並ぶ(表層微小管列、cortical array)。M期が近づくと、微小管は将来の分裂面に沿って帯状に集積する(分裂準備帯、preprophase band)。紡錘体の極は収束せず、樽状の紡錘体ができる。細胞質分裂で細胞板ができる時には、微小管は細胞板を分泌するフラグモプラスト(隔膜形成体、phragmoplast)をつくる。表層微小管列は緑藻を含む多くの緑色植物に見られるが、分裂準備帯は陸上植物の体細胞、フラグモプラストは陸上植物とその近縁の藻類にのみ見られる構造である。第二の特徴は、中心体を持たず、微小管形成が細胞内の様々な場所で起こることである。表層微小管列においては既存の微小管上で新しい微小管が形成されることがわかっている。中心体の喪失は陸上植物の体細胞に見られる現象で、多くの緑藻は中心体を持つ。参考文献 |
| 微小管マイナス端結合因子 |
|---|
| 【Microtubule minus-end binding proteins】 |
| 孟文 翔1・竹市 雅俊 2 |
| 1Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 2理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
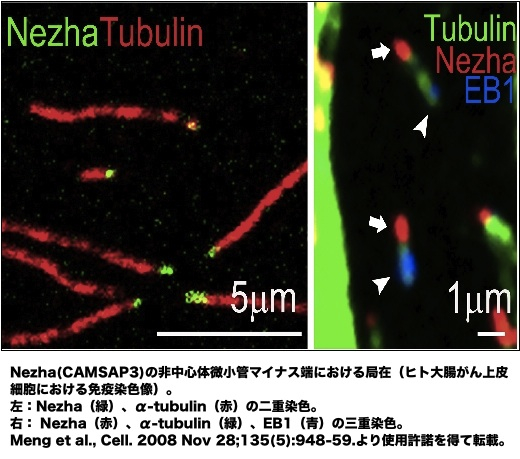
| 微小管は、プラス、マイナス両端において動的な構造体であるが、プラス端でチュ-ブリンの付加が起きやすい。この付加とマイナス端での解離がバランスされるとトレッドミル状態となることもあるが、マイナス端の脱重合速度はプラス端での重合速度よりも早いため、マイナス端が安定化されていなければ微小管は消滅する。しかし、マイナス端が何らかの形で安定化されると、微小管はブラス端だけで重合・脱重合を繰り返す[1, 2]。これが通常、細胞内でみられる微小管の状態である。 マイナス端の安定化は、中心体、またはそれ以外の細胞内構造(または分子)との結合によってもたらされ、それに対応して、微小管は中心体微小管、非中心体微小管とに分類される[2]。中心体では、γチューブリンがγ-チューブリン複合体蛋白質(γ-tubulin complex components, GCPs)と共にγチューブリン環複合体(γ-tubulin ring complex, γTuRC)を形成する。γTuRCは微小管マイナス端をキャップして安定化することで、プラス端における持続的な伸長/短縮ダイナミクスの繰り返しを可能とする。中心体は、さらに多数の成分を含み、微小管形成中心(microtubule organizing center, MTOC)としての役割を果たす[3-6]。哺乳類の細胞では、ninein、CEP192、CG-NAPとpericentrin などがγTuRCの機能を支え、これらの分子が欠損すると微小管の伸長が障害される[7-10]。 非中心体微小管は 上皮細胞、筋繊維、神経軸索等において顕著で、また、高等植物細胞はそもそも中心体を持たない。ゴルジ体、核膜、細胞膜等の構造体から非中心体微小管のプラス端重合が始まることが知られているが、その詳細な分子機構については未解明な部分が多い(繊毛微小管は、中心小体から成る基底小体から発するので、中心体微小管の一様式とみなすべきであろう)[2]。最近、微小管マイナス端結合因子Nezha(CAMSAP3)が同定され、非中心体微小管形成機構研究は新しい局面を迎えている。Nezhaは、接着結合(adherens junction, AJ)、及び、細胞質に分布し、微小管のマイナス端に結合してプラス端側の自由な伸長を支える(画像)。細胞接着部位では、Eカドヘリン-p120カテニン- PLEKHA7複合体にNezhaが結合することで微小管をAJにつなぎとめ、Nezha欠失によりAJが障害される[11, 12]。ショウジョウバエにはNezha 類似分子 Partronin(SSP4)があり、これが欠失すると細胞分裂時の紡錘体が縮小する。Partroninはマイナス端に結合することにより、キネシン13による微小管脱重合を阻害する[13, 14]。これは、Nezha/Patroninによる非中心体微小管の安定化機構をよく説明している。 またデスモソームにおいては、構成成分デスモプラキンに中心体から遊離したnineinが結合し、これが微小管をデスモソームにつなぎとめるという報告もあり、微小管マイナス端結合タンパク質が必要に応じて多様な細胞内構造に再配置される例が見つかってきている[15]。 参考文献1. Kollman, J.M., Merdes, A., Mourey, L., and Agard, D.A. Nature reviews Molecular cell biology 12:709-721 (2011)
2. Keating, T.J., and Borisy, G.G. Biol Cell 91:321-329 (1999) 3. Kollman, J.M., Polka, J.K., Zelter, A., Davis, T.N., and Agard, D.A. Nature 466:879-882 (2010) 4. Wiese, C., and Zheng, Y. Curr Opin Struct Biol 9:250-259 (1999) 5. Wiese, C., and Zheng, Y. Nat Cell Biol 2:358-364 (2000) 6. Murphy, S.M., Preble, A.M., Patel, U.K., O'Connell, K.L., Dias, D.P., Moritz, M., Agard, D., Stults, J.T., and Stearns, T. Mol Biol Cell 12:3340-3352 (2001) 7. Delgehyr, N., Sillibourne, J., and Bornens, M. J Cell Sci 118:1565-1575 (2005) 8. Gomez-Ferreria, M.A., Rath, U., Buster, D.W., Chanda, S.K., Caldwell, J.S., Rines, D.R., and Sharp, D.J. Curr Biol 17:1960-1966 (2007) 9. Takahashi, M., Yamagiwa, A., Nishimura, T., Mukai, H., and Ono, Y. Mol Biol Cell 13:3235-3245 (2002) 10. Zimmerman, W.C., Sillibourne, J., Rosa, J., and Doxsey, S.J. Mol Biol Cell 15:3642-3657 (2004) 11. Meng, W., Mushika, Y., Ichii, T., and Takeichi, M. Cell 135:948-959 (2008) 12. Akhmanova, A., and Yap, A.S. Cell 135:791-793 (2008) 13. Goodwin, S.S., and Vale, R.D. Cell 143:263-274 (2010) 14. Gardner, M.K., Zanic, M., Gell, C., Bormuth, V., and Howard. Cell 147:1092-1103 (2011) 15. Lechler, T., and Fuchs, E. J Cell Biol 176:147-154 (2007) |
| RNAの輸送 |
|---|
| 【RNA transport】 |
| 椎名 伸之 |
| 基礎生物学研究所・神経細胞生物学研究室 |
| お問合せ |
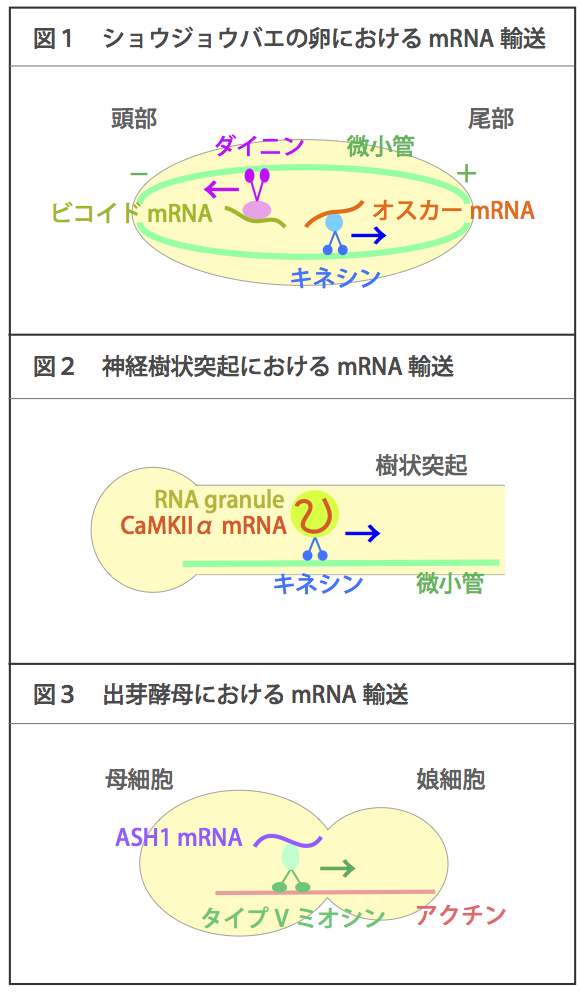
| 微小管やアクチン細胞骨格をレールとして、特定の種類のmRNAが輸送される。微小管をレールとした場合にはキネシンやダイニンをモータータンパク質として用い、アクチンをレールとした場合にはタイプVミオシンをモータータンパク質として用いることが知られている。mRNA輸送によって、細胞内の局所でタンパク質を合成して機能させることができる。 例えばショウジョウバエの卵では、微小管のマイナス端は頭部側を、プラス端は尾部側を向いて形成されている。ビコイドmRNAはダイニンによってマイナス端すなわち頭部側へ輸送され、オスカーmRNAはキネシンによってプラス端すなわち尾部側へ輸送される(図1)。頭部、尾部にそれぞれ係留されたmRNAから局所的にタンパク質が合成される結果、タンパク質局在に濃度勾配ができる。その濃度勾配は、頭部と尾部の体軸形成に必須である。 神経細胞の樹状突起では、カルモジュリンキナーゼIIα(CaMKIIα) mRNAなどが微小管をレールとしてキネシンによって輸送される。この際mRNAはRNA granuleと呼ばれる巨大複合体に取り込まれて輸送されることが知られている(図2)。mRNAはシナプス刺激入力に応じて局所的に翻訳され、局所シナプスの選択的な長期増強、ひいては記憶や学習に関与する。 また、出芽酵母では、ASH1 mRNAがアクチンをレールとしてタイプVミオシンによって母細胞から娘細胞へ輸送される(図3)。その結果、ASH1 mRNAおよび翻訳産物は娘細胞にのみ局在し、母細胞と娘細胞の運命(接合型)は異なったものになる。 参考文献 |
| 酵母の紡錘体微小管 |
|---|
| 【Spindle microtubules in yeast】 |
| 佐藤 政充 |
| 東京大学大学院理学系研究科生物化学専攻 |
| お問合せ |
| 紡錘体(スピンドル、spindle)は微小管(microtubule)の束が多数集まって構成される細胞内の構造である。真核細胞において紡錘体はゲノム染色体を2個の娘細胞に分配するために必要不可欠の役割を担う(「紡錘体微小管」の項を参照)。酵母における紡錘体微小管の基本的な機能や性質は高等生物のものと良く似ているが、相違点もいくつかある。 高等生物では一般的に紡錘体はひし形であるが、酵母では微小管が束ねられて直線状の形を示す(図参照)。また、酵母では分裂期でも核膜が崩壊しない(closed mitosisと呼ばれる)ため、紡錘体が核内に形成されるという大きな特徴がある(「酵母の核分裂」の項を参照)。 分裂酵母では、間期(interphase)に見られる細胞質の微小管構造は分裂期(mitosis)になると消失し、かわりに核内に紡錘体微小管を形成する(図参照)[1]。このように、細胞周期の時期に応じて、微小管の形成される場所が細胞質から核へと移る。その分子メカニズムはまだ明らかにされていないが、第一に微小管を安定化するタンパク質が核内に蓄積することが重要であり、第二に微小管を形成する原点であるスピンドル極体(SPB;「酵母の中心体」の項を参照)が分裂期に核膜に埋め込まれることが必要であると考えられる[2, 3]。 これに対して、出芽酵母のSPBは細胞周期を通して常に核膜に埋め込まれているため(「酵母の中心体」の項を参照)、間期でも核内にわずかながら微小管構造が存在し[4]、分裂期に突入する前のG2期の段階で紡錘体を形成する(図参照)。さらに出芽酵母では、出芽した娘細胞に核を正しく分配させるために、細胞質の微小管が細胞の内壁をたどっていき紡錘体を回転させ(spindle orientation、図参照)、核を娘細胞へと誘導する。 紡錘体微小管は、複製された染色体の動原体部位(キネトコア、kinetochore)を接着して両極に引っ張ることで染色体を分配する。微小管の接着が未完了の場合や、不適切な接着が起きた場合には、紡錘体形成チェックポイント(spindle assembly checkpoint)と呼ばれる監視機構が活性化して、すべての動原体が微小管によって正しく捕捉されるまで細胞周期を分裂中期(metaphase)に停止させる。Mad2やBub1などのチェックポイント因子は酵母からヒトまで真核細胞生物で幅広く保存されている。 参考文献 |
| 酵母の核分裂 |
|---|
| 【Closed mitosis: nuclear division in yeast】 |
| 新井 邦生・佐藤 政充 |
| 東京大学大学院理学系研究科生物化学専攻 |
| お問合せ |
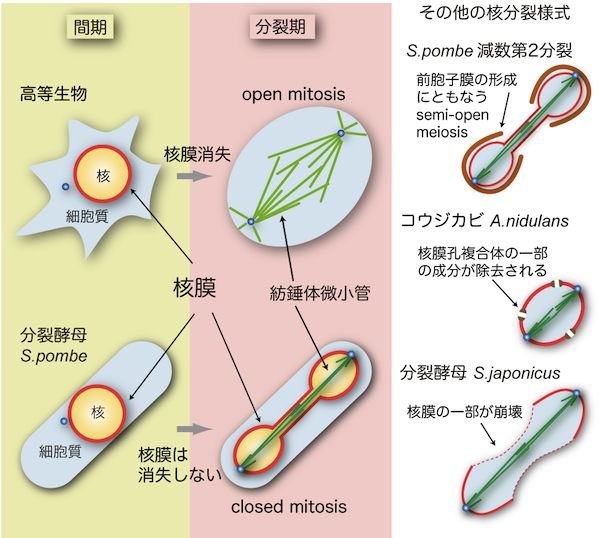
| 酵母における細胞分裂は、基本的には高等生物の細胞分裂と類似しているが、分裂期に核膜が崩壊しないことが構造上の最も大きな違いである。
高等生物では、分裂期に核膜が消失する(nuclear envelope break down, NEBD)ため、その形態はopen mitosisと呼ばれる。酵母を含む多くの単細胞生物では分裂期でも核膜が崩壊せず、closed mitosisと呼ばれる(図参照)[1]。したがって、Ran GTPaseによって統括される核・細胞質間の物質輸送は分裂期にも機能する。紡錘体微小管は核内に形成される必要がある(「酵母の紡錘体微小管」「酵母の中心体」の項を参照)が、Ranが輸送する重要な積み荷として、紡錘体微小管の形成に重要な役割を果たすAlp7/TACC (transforming acidic coiled-coil)タンパク質が知られている[2]。分裂後期(anaphase)には、紡錘体微小管が伸長することで核膜が維持されたまま核が2個に分裂する。このように、体細胞分裂において核分裂をおこすためには紡錘体微小管の伸長が不可欠である。 酵母の核分裂はclosed mitosisのみだと長らく信じられてきた。しかし近年、分裂酵母S. pombeの減数第2分裂においては、核膜は崩壊しないものの、核・細胞質間を隔てる機能が失われることが分かった(semi-open meiosis, virtual open meiosisと呼ぶ;図参照)[3,4]。減数第2分裂では配偶子(胞子)を作るために、核膜のまわりに前胞子膜(forespore membrane)と呼ばれる膜を形成する。前胞子膜が形成されることで、核膜あるいは核膜孔複合体(nuclear pore complex)にも連動して影響が生じている可能性がある。 コウジカビA. nidulansは分裂期に核膜孔複合体の一部の成分が除去されることで核・細胞質間の隔たりが無効化されるsemi-open mitosisをおこなう[5]。また、S. pombe近縁種の分裂酵母S. japonicusでは、体細胞分裂時に核膜の一部が崩壊することが分かった(図参照)[6]。このように、酵母やカビに限っても核分裂には様々な様式があることが明らかになってきた。それぞれの様式にどのような利点があるのかは推測の域を出ないが、各生物の生態に密接に関連した様式の核分裂をおこなっているのかもしれない。 参考文献 |
| 酵母の中心体:スピンドル極体 |
|---|
| 【SPB: spindle pole body】 |
| 戸谷 美夏 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
| 酵母は、動物細胞における中心体に相当する細胞内小器官として、スピンドル極体 (SPBと呼ばれることが多い)をもつ。SPBは、直径約100nm程度の円盤が重なったような、中心体とは大きく異なる構造をもつが、中心体と同様に、細胞内で微小管形成中心(MTOC: microtubule organizing center)として働いている(図参照)。SPBと中心体には、微小管の形成起点となるγチューブリン複合体 (γ-tubulin complex) が局在する。それ以外にも、SPBと中心体を構成する因子には、互いに機能的な相同性をもつタンパク質が多く含まれる。 細胞分裂時には、 SPBは、 スピンドル微小管(高等生物の紡錘体:「酵母の紡錘体微小管」の項を参照)の形成起点として両極に存在し、微小管のマイナス端を繋ぎ止めて、精確な染色体の分配に貢献している。細胞分裂により母娘細胞に分配されたSPBは、1細胞周期に1回だけの複製を行って、細胞内での数を保っている。 酵母では、細胞分裂期にも核膜が消失しないため、SPBは、核膜に埋め込まれて、核内にスピンドル微小管を形成する(「酵母の核分裂」の項を参照)。 出芽酵母のSPBは、 複製されたばかりの新しいSPBが一過的に核膜の外に観察されるが、すぐに核膜に埋め込まれ、 その後は細胞周期を通して核膜に埋め込まれて存在する。分裂酵母のSPBは、分裂期にのみ核膜に埋め込まれて核内にスピンドル微小管を形成する。間期には、核膜に添うように細胞質側に存在し、細胞質微小管のMTOCのひとつとして働いている。 減数分裂では、染色体組換えの時期に、核内の微小管がSPBによってひとつに束ねられる。分裂酵母では、SPBが先頭になって核を引っ張りまわすように動き、相同染色体の効率的な組換えを可能にしている(「酵母の微小管」の項を参照)。 SPBと中心体は、MTOCとしての働きのほかにも、情報伝達分子の足場としての役割をもつ。分裂期に重要な複数のキナーゼが、 SPB・中心体に局在することが知られている。分裂酵母では隔壁形成を制御する分子群(SIN: septation initiation network)、出芽酵母では分裂期脱出を制御する分子群 (MEN: mitosis exit network)なども、SPBに局在する。複製されたSPBが等価ではない(成熟度の違いによってOldとNewの区別が生じる)ことを利用した、非対称や極性の制御に関わるしくみの存在が示唆される。細胞分裂に非対称性を与えることも、SPB・中心体の重要な役割であると考えられる。 参考文献 |
| 紡錘体形成 |
|---|
| 【Spindle assembly】 |
| 五島 剛太 |
| 名古屋大学大学院理学研究科生命理学専攻 |
| お問合せ |
紡錘体(スピンドル:spindle)は細胞分裂の際に形成される双極性(bipolar)の構造体であり、細胞分裂装置(mitotic apparatus)と呼ぶこともある。染色体を娘細胞へと分配し、細胞質分裂を制御するために必須の役割を果たす。主要構成因子はチューブリン(tubulin)の重合体である微小管(microtubule)、および、さまざまな微小管結合蛋白質(microtubule-associated protein: MAP)である。動物体細胞においては2つの中心体(centrosome)が主な微小管形成中心(microtubule organising centre: MTOC)となり、中心体から伸びた微小管が凝縮した染色体を捕捉する。一方、植物細胞や減数分裂期の動物細胞の一部には中心体が存在せず、別のメカニズムにより紡錘体微小管が生み出されている。これまでに、染色体自身が微小管の形成を誘導することや(Ran GTPアーゼやAurora Bキナーゼが関わる)、既存の微小管に依存して新たに微小管が生み出される微小管増幅経路(オーグミン複合体が関与する)の存在が明らかにされた。また、動物体細胞においてもこうした経路が中心体経路と同時に働いていることも明らかになった。参考文献 |
| 微小管の重合核形成 |
|---|
| 【Microtubule nucleation】 |
| 五島 剛太 |
| 名古屋大学大学院理学研究科生命理学専攻 |
| お問合せ |
| 微小管(microtubule)はチューブリン(tubulin)の重合体である。試験管内では高濃度のチューブリンとGTPを混ぜると重合反応が起きて微小管が容易に生み出されるが、細胞内では通常、チューブリンは高濃度では存在せず、偶発的な重合反応が起こることは稀である。重合の際に律速となっているのは最初の段階(=重合核の形成)である。いったんチューブリンの重合が開始されると(=重合核が形成されると)、チューブリンは低濃度でも効率よく次々と付加されて微小管は伸長する。微小管の重合核形成因子としては、γチューブリン複合体(γ-tubulin complex)が知られている。試験管内でγチューブリン複合体と低濃度のチューブリンを混ぜると微小管は効率よく生み出される。細胞内では、たとえばγチューブリン複合体が多く集積している中心体では、絶え間なく微小管が生み出されている。一方、細胞内に存在するγチューブリン複合体の大半を除去してもなお一部の微小管は作り出されることから、γチューブリン複合体とは別の重合核形成因子(nucleator)が存在することも示唆されている。 なお、筆者は「重合核形成」という言葉を用いているが、「nucleation」に対する日本語訳は定まっていない。実際の日常会話では日本語でもたいていそのまま「Nucleation(ヌクリエーション)」と言っている。 参考文献 |
| チューブリンの翻訳後修飾 |
|---|
| 【Post-translational modifications of tubulin】 |
| 池上 浩司 |
| 浜松医科大学 医学部 解剖学講座 |
| お問合せ |
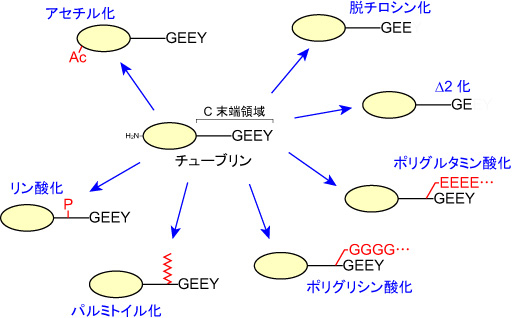
チューブリン(tubulin)は、アセチル化(acetylation)、リン酸化(phosphorylation)、パルミトイル化(palmitoylation)、脱チロシン化(detyrosination)、Δ2化、ポリグルタミン酸化(poly-glutamylation)、ポリグリシン化(polyglycylation)などの翻訳後修飾を受ける。アセチル化以外の修飾は、微小管(microtubule)表面に位置するチューブリンC末端領域に集中し、微小管表面の多様性を生み出す。修飾による微小管表面の多様性は、微小管と微小管結合タンパク質(MAPs)との相互作用に強い影響を与え、微小管の安定性や分子モーターの移動先などを制御する。参考文献 |
| 細胞分裂軸 |
|---|
| 【Cell division axis】 |
| 豊島 文子 |
| 京都大学ウイルス研究所 細胞生物学研究部門 構造形成学研究分野 |
| お問合せ |
| 細胞が分裂する方向のことであり、細胞分裂面と垂直に交わる軸方向を指す。細胞分裂軸は分裂期紡錘体の両極を結ぶ線と平行であるため、紡錘体軸の方向によって分裂軸が決定される。紡錘体軸は多くの場合、分裂中期に決定されるが、幾つかの組織・細胞では分裂後期に軸方向が変化するとの報告もある。
紡錘体軸の方向は「細胞の形」「細胞極性」「細胞―細胞間接着」「細胞ー細胞外基質接着」などの細胞内外の要因によって決定される。細胞は、周囲の環境や細胞の分化過程によって、これらの要因を使い分けている。そのため、紡錘体軸を決める分子機構は細胞や組織の種類によって異なる。進化的に保存されている紡錘体軸制御因子としてGα-LGN-NuMA複合体が広く知られている。しかし、全ての場合においてこの複合体が主要因子として機能するわけではないので、注意が必要である。 参考文献生化学 84, 81-91, 2012 |
| 微小管のダイナミック・インスタビリティ |
|---|
| 【Dynamic instability of microtubules】 |
| 清末 優子 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
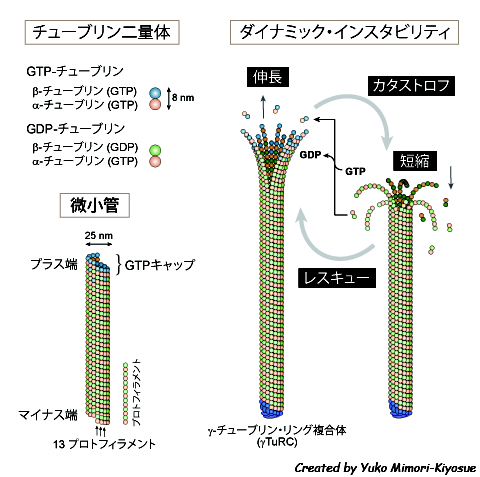
| 微小管は、α-チューブリンとβ-チューブリンのヘテロ二量体が重合して形成される、直径25 nmの筒状のフィラメントである(図)。α-/β-チューブリン二量体が同じ向きに長軸方向に共有結合してプロトフィラメントが形成され、13本のプロトフィラメントが側面で結合して微小管となる。微小管の伸長が早い端をプラス端、反対側をマイナス端とよび、プラス端先端にはβ-チューブリンが位置している。α-チューブリンとβ-チューブリンはそれぞれグアニンヌクレオチド結合部位を1個所もち、α-チューブリンは常にGTPを結合しているが、β-チューブリンのGTPは重合すると加水分解されてGDPとなり、脱重合してフリーになるとGDPが溶液中のGTPに交換されるというサイクルを繰り返している。GTPの加水分解はチューブリンの重合には必要ないが、GDP-チューブリンはフィラメントの外側に向けて反り返った構造をとり、脱重合しやすくなるため、フィラメントの速やかな崩壊をもたらす[1]。重合直後のまだGTPを保持しているチューブリンからなる先端部分は“GTPキャップ”とよばれ、脱重合を抑止して持続的な微小管伸長を助ける[2]。 個々の微小管の挙動を観察すると、精製タンパク質を用いたin vitro再構成系においても、細胞内においても、比較的ゆっくりとした伸長と、伸長よりも数倍早い速度での急速な短縮を繰り返している。この挙動はin vitroにおいても特にプラス端側で活発であるが、細胞内ではマイナス端側は安定化因子によってキャップされていることが多く非動的なため(「微小管マイナス端結合因子」の稿参照)、伸縮の繰り返しは主にプラス端側においてのみ観察される。フィラメントの端で自発的な重合と脱重合の相転換を起こすという性質は、細胞骨格ポリマーの中でも微小管に特徴的なもので、ダイナミック・インスタビリティ(動的不安定性)とよばれている[3, 4]。ダイナミック・インスタビリティのパラメータは、微小管の伸長(growth)と短縮(shrink)、伸長から短縮への変換をカタストロフ(catastrophe)、短縮から伸長への変換をレスキュー(rescue)で表す(図)。伸縮がない状態をポーズ(pause)とよぶが、チューブリンの重合・脱重合が全く生じないという状況はほとんど起こらないので、伸縮の繰り返しの距離が検出限界以下の状態ともいえる。また、系全体のダイナミクスさの程度を表す指標として、カタストロフとレスキューの頻度の総和としてダイナミシティ(dynamicity)という言葉で表すこともある。 このような動的な性質は、微小管ネットワークのパターンを必要に応じて速やかに再編するために役立つ[5]。細胞の中では、様々な因子がダイナミック・インスタビリティを調節し、微小管の長さや配置を時空間的に制御している(「古典的MAPs」「微小管不安定化因子」「微小管切断因子」「微小管の重合核形成」「微小管プラス端集積因子(+TIPs)」の稿参照)。微小管再編の最も顕著な例は、細胞分裂開始時、間期微小管が完全に崩壊して分裂期紡錘体が形成される劇的な過程であろう。間期においても、細胞構造に応じた多様な配置をとって、オルガネラの配置や物質輸送を担い、秩序だった細胞活動の基盤となっている。 参考文献1. Elie-Caille, C. et al. Straight GDP-tubulin protofilaments form in the presence of taxol. Current Biology 17, 1765-1770 (2007). 2. Howard, J. & Hyman, A.A. Growth, fluctuation and switching at microtubule plus ends. Nature Reviews Molecular Cell Biology 10, 569-574 (2009). 3. Hotani, H. & Horio, T. Dynamics of microtubules visualized by darkfield microscopy: treadmilling and dynamic instability. Cell Motil Cytoskeleton 10, 229-236 (1988). 4. Mitchison, T. & Kirschner, M. Dynamic instability of microtubule growth. Nature 312, 237-242 (1984). 5. Kirschner, M. & Mitchison, T. Beyond self-assembly: from microtubules to morphogenesis. Cell 45, 329-342 (1986). |
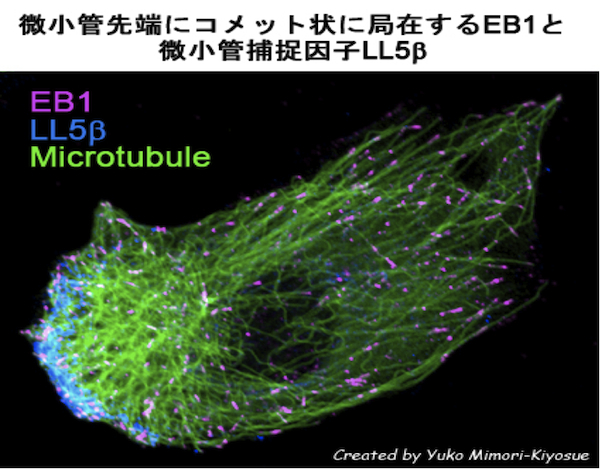
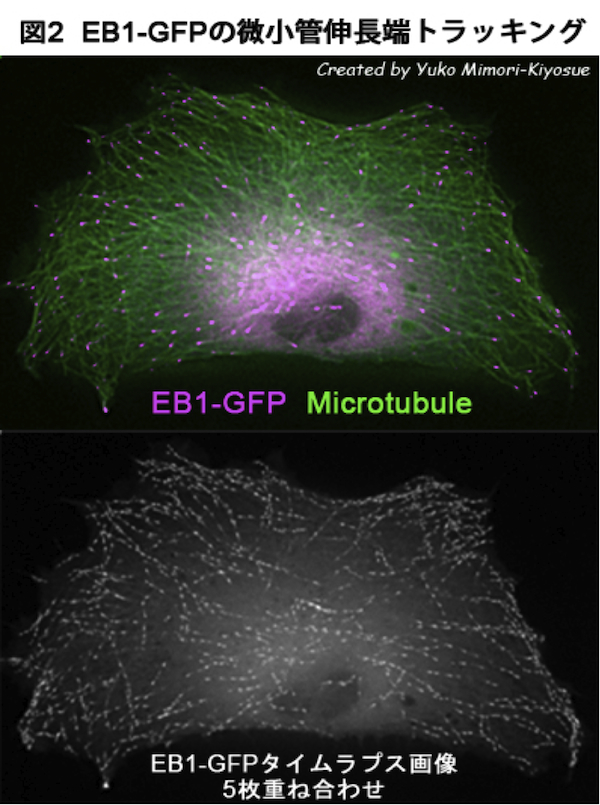
| 微小管プラス端集積因子(+TIPs) |
|---|
| 【Microtubule plus-end-tracking proteins (+TIPs)】 |
| 清末 優子 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
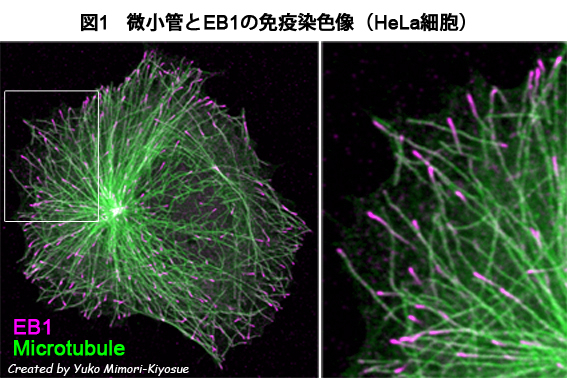
| EB1ファミリー・タンパク質 |
|---|
| 【EB1 family proteins】 |
| 清末 優子 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |

 HOME
HOME