- ホーム
- >
- 細胞生物学用語集トップ
- >
- 細胞生物学用語集【A-D】
細胞生物学用語集【A-D】
【A】
| Arp2/3複合体とアクチン重合 |
|---|
| 【Arp2/3 complex and actin polymerization】 |
| 千住 洋介・末次 志郎 |
| 東京大学 分子細胞生物学研究所 細胞形態研究分野 |
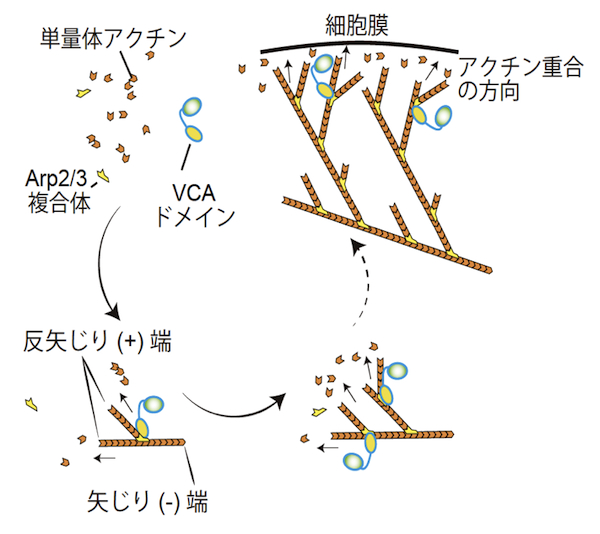
Arp2/3複合体は、二つのアクチン関連タンパク質 (actin-related protein) Arp2とArp3を含むヘテロ七量体のタンパク質複合体である。サブユニットのArp2とArp3は、ATP結合ポケットを持ち、単量体アクチン (G-actin) に似た構造を持つ。Arp2/3複合体は細胞に見られる枝分かれしたアクチン繊維の枝(branch)の基部に存在し、試験管内でも枝分かれしたアクチン繊維を形成することができる。この枝分かれ形成機構については、当初二つの説、end branchingおよびside branching、があったが、現在ではおおむね次のようなside branchingモデルに収束している。アクチンのみで行われるアクチン重合においては、単量体アクチンの3量体形成が重合核となる。したがって、Arp2/3複合体はアクチン重合に必要な重合核形成の段階で、単量体アクチンが形成する3量体のうち、2分子部分を代替すると考えられている。不活性化状態では、Arp2とArp3の配向はアクチン重合に適した方向ではないが、Arp2/3複合体とその活性化タンパク質との結合は、Arp2とArp3の配向をアクチン重合に適した方向に変える。代表的なArp2/3複合体の活性化タンパク質は、WASPファミリータンパク質であり、WASPファミリータンパク質のVCAドメインがArp2/3の活性化を担う。VCAドメインは、Arp2とArp3の配向を調節するだけでなく、3量体形成に必要な残り一つの単量体アクチンにも結合し、結合した単量体アクチンをArp2/3複合体に供給することでアクチン重合を活性化する。活性化したArp2/3複合体は、既に形成されているアクチン繊維 (F-actin) の側面に結合しつつ、アクチン重合を誘導し、アクチン繊維の枝分かれ構造を形成する【画像1】。このような枝分かれしたアクチン繊維の形成は、ラメリポディア形成やクラスリン被覆小胞のエンドサイトーシス等において重要であると考えられている。参考文献 |
| アクチン重合 |
|---|
| 【actin polymerization】 |
| 渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
アクチンは筋肉の線維性タンパク質であるが、筋細胞以外のほとんどの真核細胞にも存在し、表層の細胞骨格ネットワークの主成分を成している。アクチンは単量体、もしくは、それが数珠状につながった線維のいずれかの状態で存在する。細胞が運動するときや外来の刺激に応答し変形する際、単量体アクチンが線維に変換するアクチン重合が盛んにおきる。アクチン重合は、線維を形成する重合核形成(nucleation)と線維端に単量体が次々と付加する伸長(elongation)の2つのステップに分けることができる。重合核形成のステップでは、単量体アクチンが2量体や3量体を形成しては解離することを繰り返すため、なかなか線維が形成されない。この重合核形成を促進する分子群として、Arp2/3複合体、フォルミンファミリータンパク質、SpireなどWH2ドメインをもつものが同定されてきた。これらの重合核形成促進因子は、Rhoファミリー低分子量Gタンパク質を中心とした細胞内情報伝達機構によって活性化される。アクチン伸長は、フォルミンファミリーやVASPによって維持、もしくは加速され、逆にキャッピングプロテイン、ゲルソリンなどによって阻害される。これらの機構により細胞内のアクチン重合のタイミングは調整され、細胞表層の構造をリモデリングするとともに、細胞先端の仮足では重合端を外側に向けながら細胞膜を押す力を発生する。参考文献 |
| 原子間力顕微鏡 |
|---|
| 【Atomic Force Microscopy】 |
| 芳賀 永 |
| 北海道大学大学院生命科学院 |
| お問合せ |
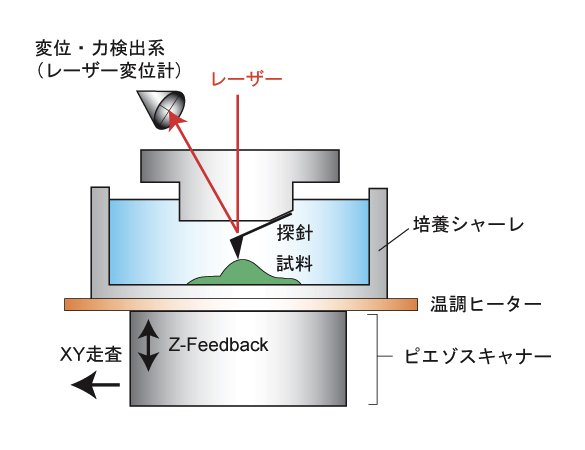
| 原子間力顕微鏡(Atomic Force Microscopy; 以下 AFM)は、生体試料の表面形状を測定することができる装置である。AFMは電子顕微鏡とは異なり、試料の固定処理を必要とせず、タンパク質や細胞の3次元的な形状を培養環境下で直接観察することが可能である。 また、カンチレバーとよばれる板バネの先端に長さ数ミクロン程度の針がついた探針を試料表面に直接接触させながら形状測定を行うため、カンチレバーのなぞり方を工夫することで、試料の形状だけではなく力学的性質(弾性率や粘着力など)の計測が可能となる(図)。 現在、AFMを用いた弾性率測定の主流はコンタクトフォースモードと呼ばれる測定法である。コンタクトフォースモードとは、探針を試料に押し込むことでカンチレバーに発生する力と試料の変形量との関係(フォースカーブ)を測定し、試料の弾性率を定量的に計測する測定法である。例えば、測定領域を64×64ピクセルに分割して、各点でフォースカーブを取得し、ピクセルごとに得られた弾性率を画像化(マッピング)することで硬さの空間分布像を得ることができる。 また、タンパク質分子のN末端とC末端をそれぞれ基盤とカンチレバーに結合させ、両端を引っ張ることにより発生する力を計測することで、タンパク質分子の折り畳みエネルギーや分子内のドメイン構造に関する情報を得ることができる。 この他、試料表面の走査を高速化することで、タンパク質一分子の移動や形の変化をビデオレートでイメージングする技術も開発されている。 参考文献 |
| 酵母のアクチン細胞骨格 |
|---|
| 【The actin cytoskeleton in yeasts】 |
| 中野 賢太郎 |
| 筑波大学大学院生命環境科学研究科 |
| お問合せ |
| 基礎研究に用いられる酵母は、主に出芽酵母 (budding yeast, Saccharomyces cerevisiae) と分裂酵母 (fission yeast, Schizosaccharomyces pombe) である。両者の進化系統の隔たりは大きいが、アクチン細胞骨格 (actin cytoskeleton) の性状については共通性が高い。そのため、酵母の研究から得られた知見は、真菌類のみならず真核生物全般にも当てはまる場合が多い。酵母の実験系では、条件致死性を利用した遺伝学的解析や相同組換えによる目的遺伝子の破壊が容易であり、細胞機能に必須な遺伝子の機能解析が自在に出来る。この特質により、アクチン、及びその調節タンパク質の細胞内の分子機能の研究において、両酵母は重要な地位を占める。
酵母には、アクチンパッチ (actin patch)、アクチンケーブル (actin cable)、そしてアクチンリング (actin ring) の3種類の構造が認められる。アクチンパッチは細胞質側に貫入した細胞膜領域を覆うように比較的短いアクチン繊維が取り巻いたもので、エンドサイトーシス (endocytosis) の際に小胞を切り離す役割を担う。通常、細胞の成長領域や分裂面では、複数のアクチンパッチが頻繁に形成と解体を繰り返す。また、それらの細胞領域から細胞質中に数本のアクチンケーブルが伸長する。これはV型ミオシン (myosin V) のレールであり、成長領域への物質輸送に寄与する。一方、アクチンリングは分裂期にのみ出現する構造で、II型ミオシン (myosin II) を構成成分として含む。これは動物細胞の収縮環に相当し、細胞質分裂 (cytokinesis) に伴い、その径を縮める。補足すると、アクチンリングの収縮に付随して、分裂面に新しい細胞壁(隔壁)が新生されることも酵母の細胞質分裂には重要である。なお酵母においては、動物細胞のように細胞膜直下を裏打ちするアクチン細胞骨格のメッシュワークは報告されていない。このような構造は、細胞壁で被われた酵母には不要なのだろう。 上記の3種類の構造の構築において、先導的な役割を担うアクチン重合促進タンパク質は、アクチンパッチでは Arp2/3 複合体 (Arp2/3 complex) が、アクチンケーブルやアクチンリングではフォルミン (formin) である。これらの活性は、Rho ファミリーの低分子量 GTPase の制御下に置かれているらしい。またアクチン束化タンパク質 (actin-bundling protein) やキャッピングタンパク質 (actin-capping protein) 、脱重合タンパク質 (actin-depolymerizing factor) などについても、動物細胞や植物細胞のものと酵母のものとで共通性が高い。 参考文献 |
| 細胞性粘菌におけるアクチン細胞骨格 |
|---|
| 【Actin-cytoskeleton in Dictyostelium cells】 |
| 祐村 恵彦 |
| 山口大学大学院医学系研究科 |
土壌生物である細胞性粘菌は,その生活環に単細胞と多細胞の時期を持つ。単細胞は走化性運動により集合することで多細胞になる。この細胞の運動は白血球に酷似しており,白血球や動物細胞の細胞運動のモデル生物として研究されている。細胞の運動機構は,細胞前端部でのアクチン繊維重合による細胞膜の押し出しと,細胞尾部に局在するミオシンII(骨格筋のミオシンに似る)によるATP依存的な尾部収縮によると考えられている。細胞性粘菌の細胞のアクチン繊維の細胞内分布を蛍光ファロイジン染色で調べると,仮足に最も多くのアクチンが存在しており,ストレスファイバーのような大きな束構造はない。これ以外にも,細胞膜を裏打ちする構造,点状の基質接着部位,尾部ではミオシンIIと相互作用できるようなアクチン繊維束が存在する。細胞質には多量の単量体のプールが存在し,細胞前端部でのアクチン繊維はArp2/3複合体により,Y字に枝分かれした状態で膜の方から重合が進行する。重合には多くのアクチン結合タンパク質が関与する。細胞分裂の最終段階である細胞質分裂時には,分裂面にアクチンとミオシンIIからなる収縮環が形成され,この構造の収縮により,細胞は2つの嬢細胞に分断される。ミオシンII欠損細胞では,収縮環依存の細胞質分裂ができないため,多核化する。参考文献Yumura, S. and T. Q. P. Uyeda. (2003).
Myosins and cell dynamics in cellular slime molds. International Review of Cytology, 224:173-226. PubMed |
| 非筋ミオシンIIの会合 |
|---|
| 【Assembly of nonmuscle myosin II】 |
| 高橋 正行 |
| 北海道大学大学院理学研究院 |
| お問合せ |
ミオシンスーパーファミリーの中でミオシンIIの際立った特徴は、会合して双極性のフィラメント(bipolar filament)を形成することである。両端に頭部を向けた双極性のフィラメント構造をとることにより、極性をもつアクチンフィラメントを両方向からたぐり寄せられる。その結果、細胞内のアクチン細胞骨格を収縮させる、或いは骨格に張力をかけることができる。ミオシンIIの会合は分子同士の静電相互作用による。会合に必須な領域(Assembly Competence Domain: ACD)は重鎖(myosin heavy chain)のα-helical coiled-coil構造からなる尾部のC末端近傍にあることがわかってきている。非筋ミオシンII(nonmuscle myosin II)のフィラメントは横紋筋ミオシンの太いフィラメント(thick filament)よりもかなり小さく、15〜30個程の分子でできている。横紋筋ミオシンはサルコメア構造内で常に太いフィラメントを形成しているのに対し、非筋ミオシンIIは細胞内で然るべき時に然るべき部位に集まって会合し、アクチンフィラメントと共に収縮性の構造体を一時的に形成する。精製したミオシンIIのin vitroにおける解析から、ミオシンIIは不活性な状態では棒状の尾部が二箇所で折り畳まれた、会合できないコンフォメーションをとり、調節軽鎖(regulatory light chain)のSer19(場合によってはThr19も)がリン酸化されると、頭部のモーター活性が上昇するのと同時に尾部が伸びたコンフォメーションに変化し会合できるようになると考えられている。細胞性粘菌のミオシンIIのフィラメント形成は重鎖のリン酸化により調節されている。一箇所で折れ曲がった尾部が脱リン酸化により伸びて会合できるようになる。脊椎動物のミオシンIIも軽鎖のリン酸化に加えて、重鎖のリン酸化による調節機構もあることがわかってきている。尾部の重鎖C末端のACDの近傍とnonhelical tailpiece(α-helical coiled-coil構造がほどけた領域)と呼ばれる領域に、PKC、CK II、TRPM7等によるリン酸化部位が存在し、リン酸化により会合能が減少する。また、他のタンパク質との相互作用による会合調節機構も存在する。S100A4/Mts1はミオシンIIアイソフォーム(IIA、IIB、IIC)のうちIIAだけに特異的に結合し脱会合状態に保たせる。その結果、ガン化した細胞の転移能を増加させることが示唆されている。参考文献 |
| 非対称分裂 |
|---|
| 【Asymmetric cell division】 |
| 入江 賢児 |
| 筑波大学大学院人間総合科学研究科(基礎医学系)分子細胞生物学グループ |
| お問合せ |
細胞分裂によって2つの異なる細胞を生じるような細胞分裂。非対称分裂は細胞の多様性を生みだす基本的なしくみである。個体発生の過程では、少数の未分化な前駆細胞(もしくは幹細胞)が細胞増殖を繰り返し、特定の機能や構造を形成する細胞集団が形成されていく。非対称分裂は、このような過程で、細胞内の非対称性や細胞外の微細環境(ニッチ、niche)に基づいて、未分化な細胞からより分化した細胞を生じるメカニズムである。
参考文献1;Mechanisms of asymmetric cell division: two Bs or not two Bs, that is the question. Horvitz HR, Herskowitz I. Cell. 1992 Jan 24;68(2):237-55.
|
【B】
| BAR ドメイン |
|---|
| 【BAR domain】 |
| 千住 洋介・末次 志郎 |
| 東京大学 分子細胞生物学研究所 細胞形態研究分野 |
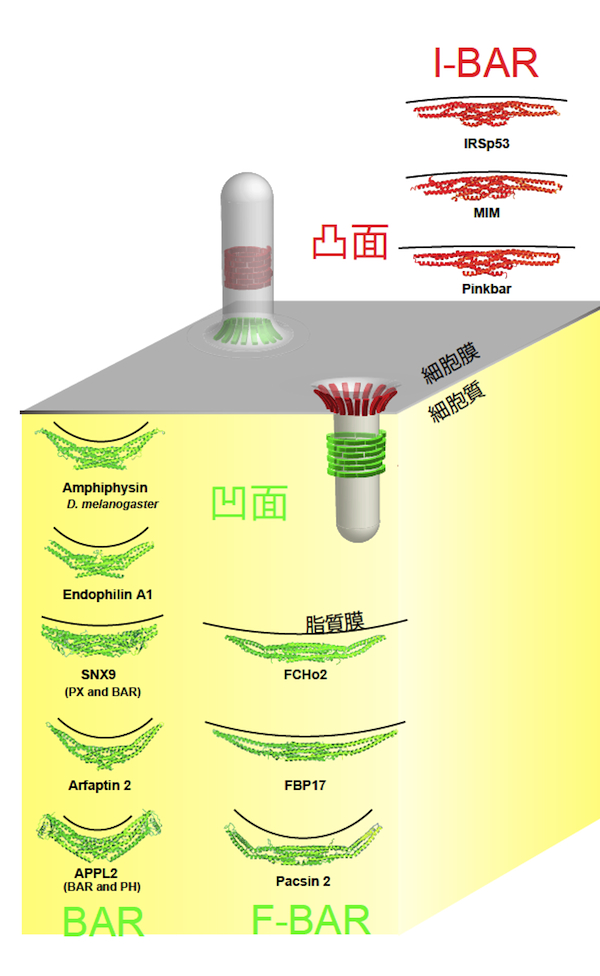
BAR (Bin/Amphiphysin/Rvs) ドメインスーパーファミリーは、BARドメインと総称される、BARドメイン、F-BARドメイン、I-BARドメインのサブファミリーに分類されるドメインを持つ。BARドメインおよびF-BARドメインは、三日月形の二量体を形成し、負に帯電している細胞膜と静電的な相互作用で結合する【画像1】。BARドメインとF-BARドメインは、三日月型二量体の立体構造における凹面が正に帯電している。この結合様式は、細胞膜の陥入構造に対応すると考えられ、実際に、多くのBARドメイン含有タンパク質 (Amphiphysin やEndophilinなど) や、F-BARドメイン含有タンパク質 (FBP17やFCHo1など) は、エンドサイトーシスなどの細胞膜の陥入構造の形成に関与する。一方、IRSp53等に含まれるI-BARドメインは、凸面が正に帯電している。よって、陥入構造とは逆の形態である、フィロポディアなどの細胞膜の突起構造の形成に関与する。また、BARドメイン、F-BARドメイン、I-BARドメインの中には、両親媒性ヘリックスなどの脂質膜に挿入されると考えられる部位を持つものがあり、この部位の挿入は、細胞膜の曲率形成を促進する。全体として、BARドメインスーパーファミリーは、細胞膜の曲率を認識、あるいは生成する機能を有すると考えられている。多くのBARドメイン含有タンパク質は、SH3ドメイン等の他のドメインを伴う。このため、BARドメイン含有タンパク質は、膜の曲率に準拠して、タンパク質を集積させる可能性がある。代表的なSH3ドメイン結合タンパク質は、Arp2/3複合体を活性化するWASPファミリータンパク質や、細胞膜を切断するダイナミン (dynamin) である。参考文献 |
【C】
| cAMPによるアクチン細胞骨格制御 |
|---|
| 【cAMP-regulated actin cytoskeleton】 |
| 福原 茂朋・望月 直樹 |
| 国立循環器病研究センター研究所 細胞生物学部 |
| お問合せ |
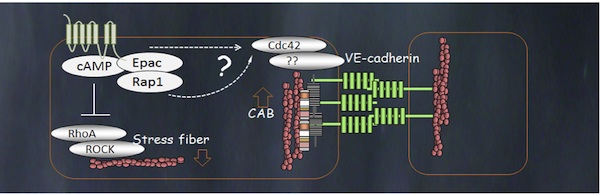
cAMPがA-キナーゼではなく、Epac (低分子量GTP結合蛋白質Rap1のグアニンヌクレオチド交換因子)の活性化によりGTP-Rap1を増加させる。さらにCdc42の活性化が生じるとともに、血管内皮細胞では、β/α-カテニンを介したVascular endothelial cadherin (VE-cadherin)とcortical actin cable (CAB)の結合が促進される。また一方、Rhoの抑制によるventral stress fiberの抑制も見られる。結果としてVE-cadherinの細胞間接着の安定化により、相対的に細胞-細胞間接着が増強され、細胞―基質間接着が減弱されることになる (図参照)。Rap1がどのようなシグナルでCdc42を活性化するのか?, Cdc42がいかにしてCABの形成を促進するのか?は不明である。Epacが発現する細胞種によってEpacの下流因子が変わるために(心臓ではRap1-PLCepsilon, 膵臓ではKチャンネルなど)アクチンの制御に関わるのがはっきりしているのはRap1-Cdc42系のシグナルが明らかな血管内皮細胞だけである。血管内皮細胞ではアドレノメデュリン受容体やアドレナリン受容体などのGs-アデニル酸シクラーゼ系を活性化するG蛋白質共役型受容体が発現するためにcAMP-Epacによるアクチン骨格制御系が機能する。A-キナーゼによるアクチン細胞骨格の直接制御についても上皮細胞・内皮細胞ともに明確な調節機構は明らかにされていない。参考文献1. Noda K, Zhang J, Fukuhara S, Kunimoto S, Yoshimura M, Mochizuki N. Vascular Endothelial-Cadherin Stabilizes at Cell-Cell Junctions by Anchoring to Circumferential Actin Bundles through a- and b-Catenins in Cyclic AMP-Epac-Rap1 Signal-activated Endothelial Cells. Mol Biol Cell. 21:584-96, 2010
2. Fukuhara S, Sakurai A, Sano H, Yamagishi A, Somekawa S, Takakura N, Saito Y, Kangawa K, Mochizuki N. Cyclic AMP potentiates VE-cadherin-mediated cell-cell contact to enhance endothelial barrier function through Epac-Rap1 siganaling pathway. Mol. Cell Biol. 25: 136-146, 2005 |
| CD分子 |
|---|
| 【Cluster of differentiation (CD) molecules】 |
| 大野 博司 |
| 理化学研究所・横浜研究所 免疫アレルギー科学総合研究センター(RCAI) |
| お問合せ |
| いくつかのモノクローナル抗体が、細胞表面の同じ抗原を認識することがあるので、混乱を避ける為にそうした抗体群を、同じ番号・記号で国際的に統一的に分類したものCD分類と呼ぶ。転じてモノクローナル抗体群が認識する同一の細胞表面抗原の名称にも用いられ、CD分子 (CD抗原)と呼称される。数年に一度開催される、human cell differentiation molecules (HCDM)のワークショップにより番号が決定され、2011年9月現在、CD1-CD350の350種類が決定されている。例えば、CD名CD1aは、CD1A抗原と記述され、CD1A抗原を認識するモノクローナル抗体のクローン名はLeu-6、O10、HI149の三種類である。いずれもHCDMのホームページに詳しい。(HCDM) 各モノクローナル抗体の供給先 (9社)も、CD分類別・モノクロナール抗体別に丁寧に記載され、リンクが貼られているので参照されたい。 |
| サイトカラシンD |
|---|
| 【Cytochalasin D】 |
| 大橋 一正 |
| 東北大学大学院生命科学研究科 |
| 真菌の毒素から単離された低分子化合物でアクチンの重合阻害剤。細胞膜透過性である。サイトカラシンB等の誘導体が複数存在する。
サイトカラシンDの作用は、アクチン繊維のプラス端に高い親和性で結合し(kd値:2 nM)、新たな重合を阻害するものである。また、弱く単量体や2量体のアクチンに結合する(kd値:2.6-17μM, Mg2+存在下)。繊維芽細胞に対して作用させた場合は、細胞内F-アクチンの脱重合を促進しないことが報告されている。これに対し、活性化した血小板に作用させた場合には、血小板内のF-アクチンが脱重合することが報告されている。これまでの報告を総合すると、定常状態の細胞に対してサイトカラシンDを作用させた場合、細胞内のF-アクチンの脱重合は促進されないと考えられる。細胞内ではアクチン線維が重合と脱重合の平衡状態にあるため、サイトカラシンDのアクチンのプラス端キャッピング活性だけではこの現象を説明できない。アクチンのプラス端キャッピング活性の他に何らかのアクチン線維の脱重合を抑制する作用があると考えられる。 参考文献 |
| αカテニン |
|---|
| 【a-catenin】 |
| 米村 重信 |
| 理化学研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
主要な細胞接着分子カドヘリン(cadherin)に対して、βカテニン(β-catenin)とともに複合体を作り、カドヘリンに依存する細胞接着に対して必須な役割を果たすタンパク質。神経系ではαNカテニンという非常に近縁のタンパク質が発現しており、それに対して一般に見られるのはαEカテニンと呼ばれる。カドヘリン接着に関してはアクチン細胞骨格との結合に関わっているという細胞内のデータやアクチン繊維との結合の生化学的データが示されている。一方、カドヘリンカテニン複合体の状態ではアクチン繊維との生化学的な結合は認められず、細胞内でもアクチン繊維結合に対して何らかの制御があると考えられる。カドヘリンを主要な接着分子とするアドへレンス・ジャンクション(adherens junction)において、カドヘリンカテニン複合体が張力を受けた時に、αカテニンはアドへレンス・ジャンクションの主要なアクチン結合タンパク質ビンキュリン(vinculin)と結合するようになる(アドへレンス・ジャンクションを補強する)機能を持ち、メカノトランスダクション(mechanotransduction)を担っているタンパク質の一つである。また、細胞接着以外に細胞の増殖などにも関与している。参考文献 |
| 古典的MAPs |
|---|
| 【Classical Microtubule-Associated Proteins】 |
| 久永 眞市 |
| 首都大学東京 / 大学院・理工学研究科 |
| お問合せ |
微小管(microtubule)を組織(主に哺乳動物の脳)や細胞から、重合・脱重合を繰り返して単離した時に、微小管を構成するチューブリン(tubulin)とともに取れてくるタンパク質で、微小管の重合や安定化活性をもつ因子。最初に見つかった微小管結合タンパク質(MAP)のため、古典的(classical)と呼ばれている。また、酵素活性など持たず、微小管壁に結合して、微小管間の距離を調節することから、構造的(Structural)MAPとも呼ばれることもある。MAP1ファミリーとMAP2/MAP4/Tauファミリーからなる。MAP1ファミリーにはMAP1A、MAP1B、MAP1Sがある。MAP1AとMAP1Bは主に神経細胞で発現し、MAP1Bは発達期の神経細胞で特に軸索(axon)に存在し、MAP1Aは成熟した脳の神経細胞の樹状突起(dendrite)に存在する。MAP1Sは多くの組織で発現している。いずれのMAP1も全長が翻訳された後、C末側の微小管に結合できる部分(軽鎖)が切断され、残りのN末側(重鎖)と複合体を形成して微小管に結合する。MAP1の軽鎖としてLC3も知られているが、これは最近オートファジー(autophagy)に関連する因子であることが判明している。MAP1は微小管安定化能を持つが、後述のMAP2よりは弱い。アクチンフィラメント(actin filament)にも結合できる。MAP2/MAP4/Tauファミリーは熱安定性で、特定の構造をもたない繊維状のタンパク質である。C末側に3-5つの微小管結合配列からなる微小管結合領域を持つ。N末側は微小管の外へ伸び出し、微小管間の距離を規定したり、他のタンパク質の結合部位となっている。微小管結合領域はアクチンとも結合でき、N末突起領域を介して、微小管とアクチンフィラメントの架橋をしている場合もある。MAP2とTauは主に神経系の細胞で発現しているが、神経細胞ではMAP2は主に樹状突起に、Tauは軸索に存在しており、それぞれの神経突起を区別するマーカーとしてよく使われている。MAP4は神経細胞以外の多くの組織や細胞でも発現している。特に増殖細胞での分裂間期と分裂期の微小管の動態(安定性)変化に大きく寄与していると考えられている。このファミリータンパクの微小管重合能はリン酸化によって制御されている。複数のプロテインキナーゼによってリン酸化され、リン酸化により微小管結合および重合能が低下する。特にTauのリン酸化はアルツハイマー病(Alzheimer's disease)で見られる神経原繊維変化(neurofibrillary tangle)の主要構成成分であることから注目をされている。また、Tau自身も前頭側頭葉型認知症(FTDP-17)の原因遺伝子であることが判っている。参考文献 |
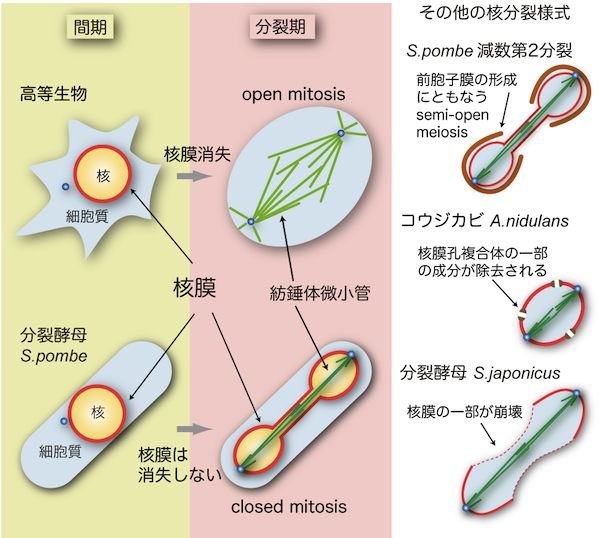
| 酵母の核分裂 |
|---|
| 【Closed mitosis: nuclear division in yeast】 |
| 新井 邦生・佐藤 政充 |
| 東京大学大学院理学系研究科生物化学専攻 |
| お問合せ |
| 酵母における細胞分裂は、基本的には高等生物の細胞分裂と類似しているが、分裂期に核膜が崩壊しないことが構造上の最も大きな違いである。
高等生物では、分裂期に核膜が消失する(nuclear envelope break down, NEBD)ため、その形態はopen mitosisと呼ばれる。酵母を含む多くの単細胞生物では分裂期でも核膜が崩壊せず、closed mitosisと呼ばれる(図参照)[1]。したがって、Ran GTPaseによって統括される核・細胞質間の物質輸送は分裂期にも機能する。紡錘体微小管は核内に形成される必要がある(「酵母の紡錘体微小管」「酵母の中心体」の項を参照)が、Ranが輸送する重要な積み荷として、紡錘体微小管の形成に重要な役割を果たすAlp7/TACC (transforming acidic coiled-coil)タンパク質が知られている[2]。分裂後期(anaphase)には、紡錘体微小管が伸長することで核膜が維持されたまま核が2個に分裂する。このように、体細胞分裂において核分裂をおこすためには紡錘体微小管の伸長が不可欠である。 酵母の核分裂はclosed mitosisのみだと長らく信じられてきた。しかし近年、分裂酵母S. pombeの減数第2分裂においては、核膜は崩壊しないものの、核・細胞質間を隔てる機能が失われることが分かった(semi-open meiosis, virtual open meiosisと呼ぶ;図参照)[3,4]。減数第2分裂では配偶子(胞子)を作るために、核膜のまわりに前胞子膜(forespore membrane)と呼ばれる膜を形成する。前胞子膜が形成されることで、核膜あるいは核膜孔複合体(nuclear pore complex)にも連動して影響が生じている可能性がある。 コウジカビA. nidulansは分裂期に核膜孔複合体の一部の成分が除去されることで核・細胞質間の隔たりが無効化されるsemi-open mitosisをおこなう[5]。また、S. pombe近縁種の分裂酵母S. japonicusでは、体細胞分裂時に核膜の一部が崩壊することが分かった(図参照)[6]。このように、酵母やカビに限っても核分裂には様々な様式があることが明らかになってきた。それぞれの様式にどのような利点があるのかは推測の域を出ないが、各生物の生態に密接に関連した様式の核分裂をおこなっているのかもしれない。 参考文献 |
| 酵母の極性と輸送 |
|---|
| 【cell polarity and polarized transport in yeast】 |
| 田中 一馬 |
| 北海道大学 遺伝子病制御研究所 疾患制御部門 分子間情報分野 |
細胞極性形成の基本的な過程は、(1) 位置のシグナル(polarity cue)、(2) 位置のシグナルからのシグナルの伝達 (signal transduction)、(3) 細胞骨格の再編成、(4) 極性輸送(polarized transport)から成る。出芽酵母の場合、(1)は出芽痕に関連しており特異的であるが、(2)、 (3)、 (4)は真核細胞に広く見られるメカニズムである。特に(2)の中心を成すのはCdc42低分子量GTP結合タンパク質(small GTPase)とそのエフェクター(effector)群であり、エフェクターの中にはフォルミン(formin)のように(3)において重要な役割を果たすタンパク質もある。酵母において輸送の原動力はミオシンV(Myo2)であって、アクチンケーブル(actin cable)に沿って輸送小胞(transport vesicles)やmRNAなどを極性形成部位へ輸送する。輸送小胞の極性形成部位近傍の細胞膜(plasma membrane)への融合はそのまま極性成長(polarized growth)へと繋がる。参考文献 |
| 細胞質とサイトゾル |
|---|
| 【cytoplasm】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| これも前項と同様,歴史と共に意味合いが変遷してきている。細胞質(cytoplasm)は,細胞のうち細胞核を除いた部分,というのがもともとの定義である。したがって,本来の意味では,核以外の細胞小器官は全て含まれることになる。しかし,これも電子顕微鏡以前の定義であり,複雑な細胞内の微細構造が理解されるようになった今,核以外を全て一緒くたにして考えるというのは,あまり効率のよい話ではない。細胞質から細胞小器官や細胞骨格などの大型の構造を除いた,可溶性の部分のことを細胞質基質(cytosol)と呼ぶが,これも,リボソームやプロテオソームなどの巨大な分子複合体が含まれるのかどうかというと,結構微妙なことになってくる。ミクロソームが,超遠心ではじめて沈殿する膜分画と定義されたように,それでも沈殿しない画分をサイトゾルと定義してしまえば,ある意味すっきりするのかもしれない。現在では,cytoplasmicとcytosolicという2つの言葉はしばしば同様の意味に用いられている。本来の定義からするとけしからぬことかもしれないが,混乱のない限りやむを得ない流れなのかもしれない。一方で,細胞小器官を含む細胞質という概念も,細胞質遺伝(ミトコンドリアゲノムおよび葉緑体ゲノムが支配する遺伝様式のこと)という言葉でしっかり残っているので,場合によっては十分な注意が必要である。 |
| 細胞質スプライシング |
|---|
| 【Cytoplasmic mRNA splicing】 |
| 吉田 秀郎 |
| 兵庫県立大学大学院生命理学研究科生体物質化学II講座 |
細胞質スプライシングは、従来知られているmRNAスプライシングとは全く異なる新規のmRNAスプライシング機構である。従来型のスプライシングは核で起こり、スプライソソームが反応を触媒する。イントロンとエクソンの境界にはコンセンサス配列(GU-AGまたはAU-AC配列)が存在し、まず5’側が切断されてラリアット構造を形成した後、3'側が切断される。しかしながら、細胞質スプライシングはスプライソソームには依存せず、小胞体ストレスセンサーであるIRE1によって切断され、未知のRNA ligaseによって結合される。エクソンとイントロンの境界にGU-AGまたはAU-AC配列は存在せず、その代わり特徴的なステム−ループ構造が存在している。細胞質スプライシングはIRE1が存在する小胞体膜上で起こり、核内では起こらないと考えられている。現在のところ、細胞質スプライシングの基質mRNAは動物のXBP1と酵母のHAC1だけである(いずれも小胞体ストレス応答を制御する転写因子)。参考文献Cell (2001) 107, 103-114
Cell (2001) 107, 881-891 |
| 細胞分裂軸 |
|---|
| 【Cell division axis】 |
| 豊島 文子 |
| 京都大学ウイルス研究所 細胞生物学研究部門 構造形成学研究分野 |
| 細胞が分裂する方向のことであり、細胞分裂面と垂直に交わる軸方向を指す。細胞分裂軸は分裂期紡錘体の両極を結ぶ線と平行であるため、紡錘体軸の方向によって分裂軸が決定される。紡錘体軸は多くの場合、分裂中期に決定されるが、幾つかの組織・細胞では分裂後期に軸方向が変化するとの報告もある。
紡錘体軸の方向は「細胞の形」「細胞極性」「細胞―細胞間接着」「細胞ー細胞外基質接着」などの細胞内外の要因によって決定される。細胞は、周囲の環境や細胞の分化過程によって、これらの要因を使い分けている。そのため、紡錘体軸を決める分子機構は細胞や組織の種類によって異なる。進化的に保存されている紡錘体軸制御因子としてGα-LGN-NuMA複合体が広く知られている。しかし、全ての場合においてこの複合体が主要因子として機能するわけではないので、注意が必要である。 参考文献生化学 84, 81-91, 2012 |
| 走化性とアクチン制御 |
|---|
| 【Chemotaxis and f-actin regulation】 |
| 上村 陽一郎・上田 昌宏 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
走化性(あるいはケモタキシス、chemotaxis)とは、細胞が外界の化学物質の濃度勾配を認識して示す誘因あるいは忌避運動のことである。走化性は多くの生物現象で重要な役割をもち、例えば、胚発生、神経回路の形成、あるいはがん細胞の原発巣からの転移(metastasis)に走化性が利用されている。特に白血球(leukocyte)の一つである好中球(neutrophil)が走化性により炎症あるいは感染部位へ集まることが昔からよく知られている。走化性研究には上記の好中球や微生物である細胞性粘菌(Dictyostelium discoideum)が用いられており、これらの細胞は進化的に離れているものの、その分子機構はよく似ている。走化性物質(chemoattractantあるいはchemorepellant)は7回膜貫通のGタンパク質共役型受容体(G protein coupled receptor)により感知され、三量体Gタンパク質(trimeric G protein)を介して下流の細胞運動装置を制御する。細胞は運動方向に顕著な極性をもち、細胞の前方では盛んにアクチン重合(F-actin polymerization)がおこり、仮足(pseudopod)形成が促進される。一方、細胞の後方ではミオシンII(MyosinII)が局在し、収縮力(contractile force)を発生することで、方向性のある細胞運動を効率的に制御すると考えられる。アクチン重合が細胞前端で局所的に起こるしくみは断片的にしか明らかでないが、リン脂質の一つであるホスファチジルイノシトール三リン酸(phosphatidylinositol(3,4,5)trisphospate)がメディエーターとして重要であると考えられている。参考文献 |
【D】
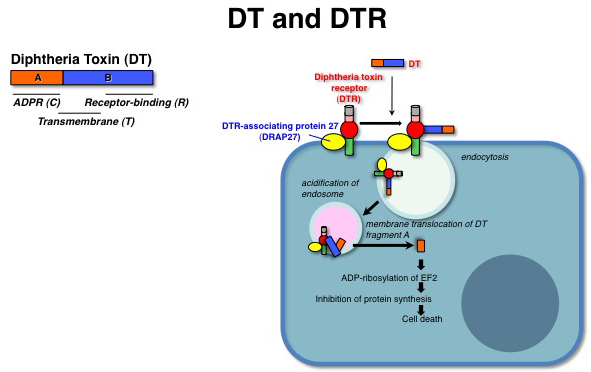
| ジフテリア毒素受容体 |
|---|
| 【Diphtheria toxin receptor (DTR)】 |
| 目加田 英輔 |
| 大阪大学微生物病研究所細胞機能分野 |
ジフテリア毒素(DT)は毒素活性を担うAフラグメントと受容体結合を担うBフラグメントからなる毒素分子である。DTは細胞表面のジフテリア毒素受容体(DTR)への結合を介してエンドサイトーシスされ、エンドソームの酸性化に伴うDTの構造変化によってAフラグメントがエンドソームの脂質二重膜を通過して細胞質に放出される。フラグメントAはペプチド伸長因子EF-2をADPリボシル化することで蛋白合成を阻害し、細胞を死に至らしめる。DTRの本体はEGFファミリーの増殖因子HB-EGFの膜型前駆体(proHB-EGF)である。ヒトやサルなどの細胞はDT感受性なのに対し、マウスやラットの細胞はDT抵抗性である。これはDTRのDT結合部位(proHB-EGFのEGF様領域)のアミノ酸の違いによるDT結合性の相違による。DTのDTR (proHB-EGF)への結合特異性は非常に高く、DTは他のEGFファミリーやマウス型HB-EGFには全く結合しない。DTRはテトラスパニンCD9と細胞膜上で複合体を形成することでその細胞表面量が増加するが、その機構は未だ明らかではない。 参考文献蛋白質核酸酵素 46, 506-511, 2001 |
| 上皮細胞の細胞間接着構造形成 |
|---|
| 【Development of the epithelial cell-cell junctions and actin cytoskeleton】 |
| 鈴木 厚 |
| 横浜市立大学大学院医学研究科 |
| お問合せ |
| 上皮細胞はその特有の機能を果たす必要性から、細胞周囲を一周取り囲む連続的な接着構造を2種類---密着結合(tight junction)、および接着帯(adherens junction)---を発達させている。これらの接着構造の発達の素過程は、confluentな単層の培養上皮細胞を一部、針等でスクラッチし、その傷が埋まる過程(wound healing)をライブセルイメージングで観察する実験などを通じて研究されてきた。
これまでに、上皮細胞においても、線維芽細胞にも見られるような点状の接着構造(dot-like adherens junction)が最初に形成され、それが次第に融合し、最終的に2種に分化した連続的な接着構造に発達することが明らかとされている。ただ上皮細胞では、この初期接着構造にE-cadherinだけでなく、将来タイトジャンクションを構成するclaudin, occludin, JAMなどの膜タンパク質がすべてrecruitされてくるという特徴がある。 この発達過程においては、初期の点状接着構造から細胞内部に伸長するアクチン線維、および、上皮細胞特有にみられる周辺部(peripheral)の環状のアクトミオシン線維の求心性の収縮力が重要な役割を果たしていることが分かっている。さらに、Rho, Rac, alpha-caten、さらには極性制御因子であるPAR-aPKCシステムもこの過程の進行に必須な役割をしている。ただ、いかなる分子機構でこの過程が進行するのかという点については、まだ多くが不明である。 参考文献 |
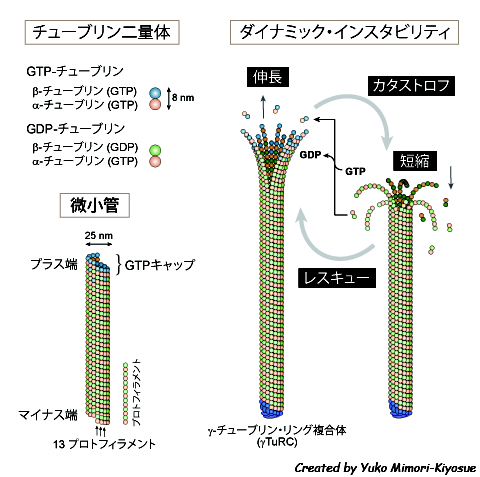
| 微小管のダイナミック・インスタビリティ |
|---|
| 【Dynamic instability of microtubules】 |
| 清末 優子 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
| 微小管は、α-チューブリンとβ-チューブリンのヘテロ二量体が重合して形成される、直径25 nmの筒状のフィラメントである(図)。α-/β-チューブリン二量体が同じ向きに長軸方向に共有結合してプロトフィラメントが形成され、13本のプロトフィラメントが側面で結合して微小管となる。微小管の伸長が早い端をプラス端、反対側をマイナス端とよび、プラス端先端にはβ-チューブリンが位置している。α-チューブリンとβ-チューブリンはそれぞれグアニンヌクレオチド結合部位を1個所もち、α-チューブリンは常にGTPを結合しているが、β-チューブリンのGTPは重合すると加水分解されてGDPとなり、脱重合してフリーになるとGDPが溶液中のGTPに交換されるというサイクルを繰り返している。GTPの加水分解はチューブリンの重合には必要ないが、GDP-チューブリンはフィラメントの外側に向けて反り返った構造をとり、脱重合しやすくなるため、フィラメントの速やかな崩壊をもたらす[1]。重合直後のまだGTPを保持しているチューブリンからなる先端部分は“GTPキャップ”とよばれ、脱重合を抑止して持続的な微小管伸長を助ける[2]。 個々の微小管の挙動を観察すると、精製タンパク質を用いたin vitro再構成系においても、細胞内においても、比較的ゆっくりとした伸長と、伸長よりも数倍早い速度での急速な短縮を繰り返している。この挙動はin vitroにおいても特にプラス端側で活発であるが、細胞内ではマイナス端側は安定化因子によってキャップされていることが多く非動的なため(「微小管マイナス端結合因子」の稿参照)、伸縮の繰り返しは主にプラス端側においてのみ観察される。フィラメントの端で自発的な重合と脱重合の相転換を起こすという性質は、細胞骨格ポリマーの中でも微小管に特徴的なもので、ダイナミック・インスタビリティ(動的不安定性)とよばれている[3, 4]。ダイナミック・インスタビリティのパラメータは、微小管の伸長(growth)と短縮(shrink)、伸長から短縮への変換をカタストロフ(catastrophe)、短縮から伸長への変換をレスキュー(rescue)で表す(図)。伸縮がない状態をポーズ(pause)とよぶが、チューブリンの重合・脱重合が全く生じないという状況はほとんど起こらないので、伸縮の繰り返しの距離が検出限界以下の状態ともいえる。また、系全体のダイナミクスさの程度を表す指標として、カタストロフとレスキューの頻度の総和としてダイナミシティ(dynamicity)という言葉で表すこともある。 このような動的な性質は、微小管ネットワークのパターンを必要に応じて速やかに再編するために役立つ[5]。細胞の中では、様々な因子がダイナミック・インスタビリティを調節し、微小管の長さや配置を時空間的に制御している(「古典的MAPs」「微小管不安定化因子」「微小管切断因子」「微小管の重合核形成」「微小管プラス端集積因子(+TIPs)」の稿参照)。微小管再編の最も顕著な例は、細胞分裂開始時、間期微小管が完全に崩壊して分裂期紡錘体が形成される劇的な過程であろう。間期においても、細胞構造に応じた多様な配置をとって、オルガネラの配置や物質輸送を担い、秩序だった細胞活動の基盤となっている。 参考文献1. Elie-Caille, C. et al. Straight GDP-tubulin protofilaments form in the presence of taxol. Current Biology 17, 1765-1770 (2007). 2. Howard, J. & Hyman, A.A. Growth, fluctuation and switching at microtubule plus ends. Nature Reviews Molecular Cell Biology 10, 569-574 (2009). 3. Hotani, H. & Horio, T. Dynamics of microtubules visualized by darkfield microscopy: treadmilling and dynamic instability. Cell Motil Cytoskeleton 10, 229-236 (1988). 4. Mitchison, T. & Kirschner, M. Dynamic instability of microtubule growth. Nature 312, 237-242 (1984). 5. Kirschner, M. & Mitchison, T. Beyond self-assembly: from microtubules to morphogenesis. Cell 45, 329-342 (1986). |

 HOME
HOME