- ホーム
- >
- 細胞生物学用語集トップ
- >
- 細胞生物学用語集【M-O】
細胞生物学用語集【M-O】
【M】
| M細胞、GP2 |
|---|
| 【Microfold cell (M cell)、Glycoprotein2 (GP2) 】 |
| 大野 博司 |
| 理化学研究所・横浜研究所 免疫アレルギー科学総合研究センター(RCAI) |
| お問合せ |
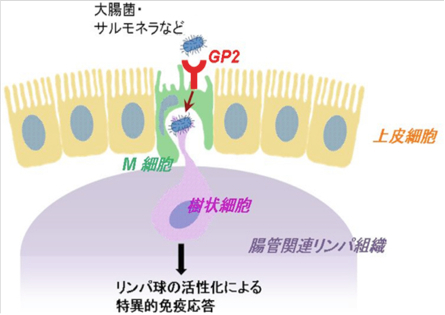
| Microfold cell (M cell)はパイエル板を始めとする粘膜関連リンパ組織を覆う特殊な上皮層に点在する抗原取り込み細胞である。M細胞は周囲の腸管吸収上皮細胞とは形状が異なり、微絨毛が短く疎で、基底膜側は免疫細胞を抱え込むための陥凹した空間を持つ(図1)。このような特徴により粘膜組織に侵入した外来抗原を免疫細胞へと効率よく受け渡すことができる。
Glycoprotein2(以下GP2)はGPI-アンカー型タンパク質の一つで、膵臓腺房細胞に限局して発現する機能未知の分子として同定された(文献1)。その後の研究からマウス、ヒトのM細胞の頂端面細胞膜に発現することが見出され、1型線毛の先端に表出するFimHタンパク質を認識することが明らかとなった(文献2)。M細胞においてGP2は1型線毛を持つ細菌を選択して認識し、細胞内へと取り込むための受容体であり、粘膜免疫にける免疫監視において重要な役割を担う分子である(図1)。 参考文献文献1. Fukuoka S, et al. Proc Natl Acad Sci U S A. 1992 Feb 15 89(4):1189-93. 文献2. Hase K, et al. Nature. 2009 Nov 12 462(7270):226-30. 理化学研究所、免疫系構築研究チーム 抗体情報:販売元MBL Anti-GP2 / Glycoprotein2Anti-GP2 / Glycoprotein2 (Mouse) |
| アクチン繊維によるメカノセンシング |
|---|
| 【Mechanosensing by actin filaments】 |
| 上田 太郎 |
| 産業技術総合研究所 バイオメディカル研究部門 |
| お問合せ |
| アクチン繊維は弾性をもった二重らせんであり、引っ張ればわずかに長くなる[1,2,3]。Shimozawaら[4]は、蛍光標識したアクチンの蛍光強度がin vitroの張力負荷によって変化することを見出しているし、Matsushitaら[5]は、分子動力学シミュレーションにより、張力負荷がアクチン繊維の長さとらせんピッチ両方を伸ばすことを報告している。したがって張力負荷されたアクチン繊維の長さとらせんピッチがばねのように伸びることは間違いない。しかしこのことが直ちにアクチン繊維がメカノセンサーであることを意味するわけではない。アクチン繊維がメカノセンサーとして機能するためには、張力負荷によりアクチン繊維としての機能が変化し、何らかのシグナル伝達の起点になければならないからである。しかしアクチン繊維は弾性係数が大きく(バネとして固い)、生理的な張力負荷で伸びる割合が小さい(0.3%程度)ため、これがシグナル伝達の起点になるという考えは一般的ではなかった。
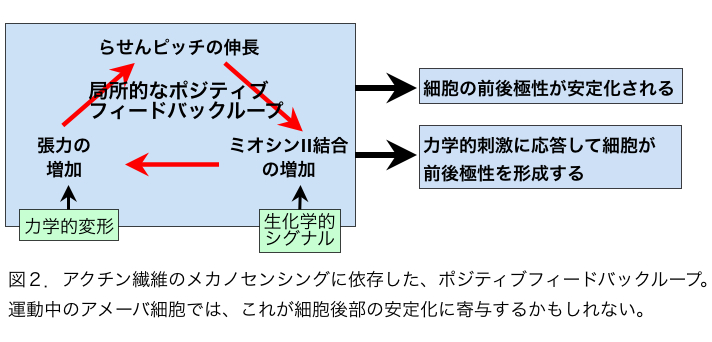
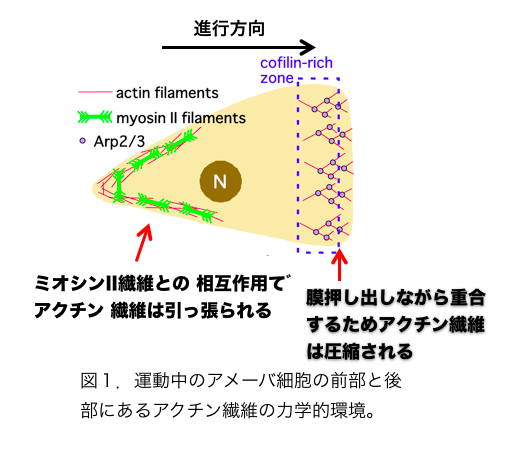
こうした状況にあって、2011年にアクチン繊維はメカノセンサーであることを示す論文が2報、わが国の研究者から発表された。論文発表は同じ2011年でも学会発表が先行していたという意味で第一にあげるべきは、名古屋大の早川、辰巳、曽我部らによる、コフィリンとアクチン繊維の相互作用に関する論文である[6]。彼らはin vitroの実験で、コフィリンは張力のかかったアクチン繊維と結合しにくく、また切断しにくいことを発見し、さらにセミインタクトおよびインタクトなhuman umbilical vein endothelial cells (HUVECs)において、コフィリンが張力のかかっていないストレスファイバーと選択的に結合することも示した。張力のかかっていないストレスファイバーが崩壊しやすいことは以前から知られており、アクチン繊維のメカノセンシングに依存したコフィリン活性がこの現象に関与すると示唆されたわけである。もう一つの例は張力に依存したアクチン繊維とS1(ミオシンIIのモータードメイン)の結合である[7]。これはもっぱら生きた細胞性粘菌細胞を用いた観察で、GFP−S1が張力がかかっている細胞内アクチン繊維と優先的に結合することを報告ている。この現象は、S1にアクチンとの親和性を高める変異が必要であること、またミオシンIIとアクチン繊維の相互作用を調節することが知られている既知のタンパク質に依存しないことなどから、張力のかかったアクチン繊維に特徴的な構造をS1が直接認識して優先的に結合したと解釈された。興味深いことに、ミオシンIIのS1は張力負荷アクチン繊維と優先的に結合したが、ミオシンIのモータードメインはそうした選択性を示さなかった。この現象は、ミオシンIIは本来、細胞後部でフィラメントを形成してアクチン繊維と相互作用し、張力を発生させるのに対し、ミオシンIは細胞前部に局在して張力発生には関与しないことと関連があるのかもしれない。現在のところ、アクチン繊維のメカノセンシングが関与することが示唆されているのは、コフィリンおよびミオシンIIとアクチン繊維の相互作用だけであるが、アクチン繊維の構造が張力負荷で変化するなら、他のアクチン結合タンパク質との相互作用もアクチン繊維のメカノセンシングにより様々な調節を受けていると推測される。 アクチン系細胞骨格と相互作用するメカノセンサーはすでにいくつか知られている[8,9,10,11,12]。一方、アクチン繊維は非常に多数の因子と相互作用する多機能構造であり、かつ細胞表層全体に張り巡らされたネットワークであるため、アクチン繊維自体がメカノセンサーであることには、細胞全体の活性をコーディネートしうるという意味で大きな生理的意義をもちうる。こうした観点から議論しておきたいことは、アクチン繊維の構造多型と機能分化の関連である。そもそもアクチン繊維が単体で構造的多型性をもつという概念はE.H.Egelmanらの電子顕微鏡観察によりかなり以前から提唱されていた[13,14,15] (ただし最近のFujiiらの電子顕微鏡観察[16]はアクチン繊維の構造多型性に否定的であり、決着はついていない)が、その生理的意義は不明確であった。しかしコフィリンを初めとする種々のアクチン結合タンパク質の結合が、アクチンサブユニットの構造を変化させることが明らかとなり[17]、これがアクチン結合タンパク質とアクチン繊維の結合が協同的であることの構造的基盤であると提唱され[18]、アクチン繊維の構造多型の生理的意義がおぼろげながら見えてきた。つまり、たとえばコフィリンがアクチン繊維のあるサブユニットに結合すると、そのサブユニットの構造が「コフィリン結合型」に変化し、さらにこの構造変化が隣接するサブユニットの構造もコフィリン結合型に変化させる(協同的構造変化)と、その隣接サブユニットとコフィリンの親和性が増加し、結果的にコフィリンのクラスターが形成される(協同的結合)という考え方である。一方、ミオシンIIがアクチン繊維に結合すると、張力とは無関係にアクチン繊維のらせんピッチがわずかに延びることが報告されており[19]、またHMM(ミオシンIIの可溶性断片)は、微量のATP存在下でアクチン繊維と協同的に結合することも報告されている[20]ので、ミオシンIIモーターとアクチン繊維の協同的相互作用にもコフィリンの場合と同様、アクチン繊維の協同的構造変化が関与する可能性がある。ただしらせんピッチの伸び縮みの方向が逆なので、コフィリン結合によるアクチン繊維の協同的構造変化と、ミオシンII結合によるアクチン繊維の協同的構造変化はまったく異なったものであろう。この仮想的メカニズムには、細胞内のアクチン繊維の機能分化を安定化させる作用が期待でき、大変魅力的である(図1,2)。 参考文献1. Kojima H, Ishijima A, Yanagida T (1994) Proc Natl Acad Sci U S A 91: 12962-12966.
2. Huxley HE, Stewart A, Sosa H, Irving T (1994) Biophys J 67: 2411-2421 3. Wakabayashi K, Sugimoto Y, Tanaka H, Ueno Y, Takezawa Y, et al. (1994) Biophys J 67: 2422-2435. 4. Shimozawa T, Ishiwata S (2009) Biophys J 96: 1036-1044. 5. Matsushita S, Inoue Y, Hojo M, Sokabe M, Adachi T (2011) J Biomech 44: 1776-1781. 6. Hayakawa K, Tatsumi H, Sokabe M (2011) J Cell Biol 195: 721-727. 7. Uyeda TQ, Iwadate Y, Umeki N, Nagasaki A, Yumura S PLoS One 6: e26200. 8. Yonemura S, Wada Y, Watanabe T, Nagafuchi A, Shibata M (2010) Nat Cell Biol 12: 533-542. 9. Sawada Y, Tamada M, Dubin-Thaler BJ, Cherniavskaya O, Sakai R, et al. (2006) Cell 127: 1015-1026. 10. Kee YS, Robinson DN (2008) Curr Biol 18: R860-862. 11. Pramanik MK, Iijima M, Iwadate Y, Yumura S (2009) Genes Cells 14: 821-834. 12. del Rio A, Perez-Jimenez R, Liu R, Roca-Cusachs P, Fernandez JM, et al. (2009) Science 323: 638-641. 13. Egelman EH, Francis N, DeRosier DJ (1982) Nature 298: 131-135. 14. Galkin VE, Orlova A, Schroder GF, Egelman EH (2010) Nat Struct Mol Biol 17: 1318-1323. 15. Orlova A, Prochniewicz E, Egelman EH (1995) J Mol Biol 245: 598-607. 16. Fujii T, Iwane AH, Yanagida T, Namba K (2010) Nature 467: 724-728. 17. Galkin VE, Orlova A, Lukoyanova N, Wriggers W, Egelman EH (2001) J Cell Biol 153: 75-86. 18. Ressad F, Didry D, Xia GX, Hong Y, Chua NH, et al. (1998) J Biol Chem 273: 20894-20902. 19. Tsaturyan AK, Koubassova N, Ferenczi MA, Narayanan T, Roessle M, et al. (2005) Biophys J 88: 1902-1910. 20. Tokuraku K, Kurogi R, Toya R, Uyeda TQP (2008) J Mol Biol 386: 149-162. |
| ミオシンII阻害剤 (blebbistatin, Y27632, ML7など) |
|---|
| 【Myosin inhibitors (blebbistatin, Y27632, ML7)】 |
| 米村 重信 |
| 理化学研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
| Blebbistatinには鏡像異性体の(-)体と(+)体とがあり、(-)体が効果を持ち、(+)体には効果がない。(-)体は横紋筋のミオシンII、非筋ミオシンIIのATPase活性をIC=0.5-5μM程度の強さで阻害する。培養細胞には(-)体なら5-50μMの濃度を使用することが多い。ミオシン-ADP-Pi複合体に結合し、リン酸の放出を抑制することでATPaseのサイクルを阻害する。平滑筋のミオシンIIやショウジョウバエの非筋ミオシンIIには効果がない。ミオシンIIは脱リン酸化を受けるわけではなく、会合したまま存在する。細胞性粘菌のミオシンIIにも効果を持つが、ミオシンIIを発現しない細胞性粘菌の一部の活動を抑制することから、副作用がないわけではないことがわかっている。GFPを励起する波長によりblebbistatinが細胞毒性を示すため、ライブイメージングのためには、より長波長で励起される蛍光分子を用いることが必要である。
BDM(2,3-butanedione monoxime)も一般的なミオシンIIの阻害剤として使用されるが、骨格筋ミオシンIIには作用があるものの、非筋ミオシンIIに対しては阻害効果がないこと、むしろアクチン重合への阻害が見られることがわかっている。 Y27632はROCK/Rho-kinaseをATPと拮抗的に阻害する。細胞においては10-30μM程度の濃度でよく使用される。ROCK/Rho-kinase活性の阻害により基質の一つであるミオシン調節軽鎖(MRLC)のリン酸化は抑制され、また別の基質であるMYPT1のリン酸化が抑制されることによりMYPT1をサブユニットとするミオシンフォスファターゼが活性化し、MRLCの脱リン酸化が亢進する。これによりミオシンIIのATPase活性の低下、脱重合が起こるため、細胞内のミオシンIIの機能は低下する。ストレスファイバーの崩壊など、アクチン細胞骨格の大きな変化が見られる。ROCK/Rho-kinaseの基質は他にもあるものの、多くの細胞において上記の変化は目立つ。 ML7とML9はそれぞれミオシン軽鎖キナーゼ(MLCK)をATPと拮抗的に阻害する。しかしその細胞への使用には大いに注意が必要である。MLCKによるリン酸化部位を擬似リン酸化型に変えた変異MRLCを発現する細胞では、Y27632で処理をしてもその変異MRLCは影響を受けずに機能し続けるのでストレスファイバーに変化はないが、ML7で処理をするとストレスファイバーは崩壊する。これはML7がMRLCのリン酸化を介さずにアクチン細胞骨格に大きな作用をするということを示している。これが他の既知や未知のキナーゼの阻害によるものかはわかっていない。実際にMLCKのノックアウトマウスでもほぼ正常な胚発生を行うことから、MLCKが重要な働きをする細胞はかなり限られていると考えられる。 参考文献Straight, A. F. et al. (2003) Science. 299, 1743-1747.
Shu, S. et al. (2005) Proc Natl Acad Sci U S A. 102, 1472-1477. Yarrow, J. C. et al. (2003) BMC Cell Biol. 4:5 Uehata, M. et al. (1997) Nature 389, 990-994. Watanabe, T. et al. (2007) Mol Biol. Cell. 18, 605-616. Somlyo, A. V. et al. (2004). J. Muscle Res. Cell Motil. 25, 241-242. |
| メカノトランスダクション |
|---|
| 【mechanotransduction】 |
| 米村 重信 |
| 理化学研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
機械的刺激(情報)を生化学的シグナルに変換すること。関連する言葉のメカノセンシング(mechanosensing)は機械的刺激を知覚することで、分子レベルでは、機械的刺激によって分子が構造変化を起こすことに対応する。メカノレスポンス(mechanoresponse)は機械的刺激から生体の反応(メカノトランスダクション以降に起こる、細胞骨格の変化や遺伝子発現など)が起こること。メカノトランスダクションは構造変化を起こした分子が、生化学的シグナルを引き起こす段階である。この場合の生化学的シグナルには、チャンネルの開閉、酵素活性の制御、タンパク質との結合などが含まれる。参考文献 |
| 筋原線維(筋原繊維) |
|---|
| 【Myofibril】 |
| 遠藤 剛 |
| 千葉大学大学院理学研究科 |
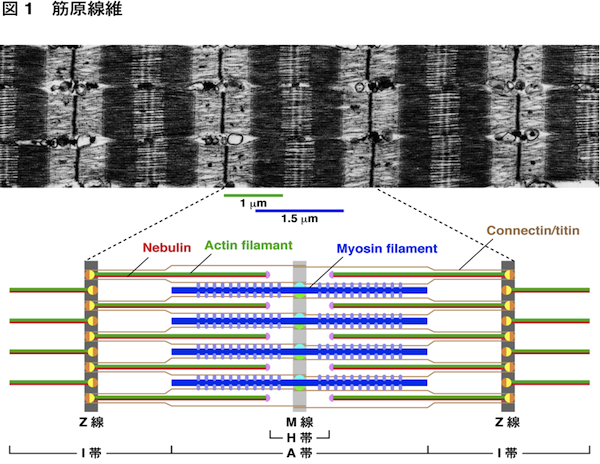
| 骨格筋や心筋は収縮することにより,からだの各部の動きや心臓の拍動を担っている.この収縮を担っている筋細胞内の構造が筋原線維である.筋原線維は直径が約1 μmで細長い円筒状の構造で,筋細胞内にぎっしり詰まっている.筋原線維を構成するミオシン線維がアクチン線維をたぐり寄せて滑り込ませることにより,筋収縮が起こる.アクチン線維は長さが約1 μmに揃っている.その反やじり端はZ線(Z帯,Z盤)に入り込んでおり,Z線で固定されている.一方,ミオシン線維は長さが約1.5 μmに揃っている.中央のM線(M帯)から両側に向かって伸びており,M線で固定されている.Z線から次のZ線の間をサルコメア(sarcomere)と呼び,筋原線維の構成単位である.
コネクチン/タイチン(connectin/titin)は分子量が3,000-3,700 kDaの最大のタンパク質であり,Z線とM線をつないでいる.ばねの働きをする部位があり,ミオシン線維をサルコメアの中央に位置させたり,受動的張力によりサルコメアの長さを保持している.またネブリン(nebulin)は骨格筋特異的に発現している分子量が600-900 kDa,長さが約1 μmの巨大タンパク質で,Z線からアクチン線維のほぼ全長にわたって伸びている.Z線からアクチン線維が形成される時には,ネブリンに沿って伸長する.心筋にはネブリンは存在せず,代わりに長さが約0.15 μmのネブレット(nebulette)が存在している.α-アクチニン(α-actinin)はZ線に局在して,アクチン線維同士を架橋している.アクチン線維の溝に沿って,トロポミオシン(tropomyosin)とそれに結合したトロポニン(troponin)複合体(T, I, Cの3つのサブユニットから成る)が存在している.トロポニンはミオシンとアクチンの相互作用を阻害するが,トロポニンにCa2+が結合することにより,この阻害が解除されて筋収縮が起こる.筋原線維中のトロポミオシン-トロポニンを含むアクチン線維を細い線維(thin filament)と呼ぶ.一方,ミオシン線維には,ミオシン結合タンパク質C(MyBP-C),M線に局在するMタンパク質(M-protein)やマイオメシン(myomesin)などが結合している.筋原線維中のこれらのタンパク質を結合したミオシン線維を太い線維(thick filament)と呼ぶ.筋原線維にはこれらのタンパク質以外にもいくつものタンパク質が存在するが,機能が十分に解明されていないものも多い. 筋細胞はインスリン様増殖因子1(IGF-1)が作用することによって肥大するが,その過程で筋原線維が形成される.IGF-1によって活性化されたホスファチジルイノシトール3-キナーゼ(PI3K)-Aktシグナリングを介して,Z線でネブリンのC末端にN-WASPが結合する.この複合体がアクチン重合核形成因子として働き,Z線でアクチン重合核が形成される.さらにZ線からネブリンに沿ってアクチン線維が伸長する.こうして筋原線維のアクチン線維が形成される.一方,IGF-1によるミオシン線維形成の機構はまだ不明である. 参考文献(1) Clark, K.A., et al. (2002) Annu. Rev. Cell Dev. Biol. 18, 637-706.
(2) Lange, S., Ehler, E., Gautel, M. (2006) Trends Cell Biol. 16, 11-18. (3) 高野和儀,遠藤 剛 (2011) ライフサイエンス新着論文レビュー (4) 高野和儀,渡邊-高野晴子,遠藤 剛 (2011) 実験医学 29, 1273-1276. |
| 小胞体とミクロソーム |
|---|
| 【microsomes】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| 小胞体はendoplasmic reticulum(細胞質中に広がる網状の構造の意)の日本語訳であり,ずいぶん本来の意味とニュアンスが異なっている。私見ではあるが,これはミクロソーム(microsomes)の直訳が転用され,定着したのではないかと思っている。ミクロソームは,細胞破砕液(homogenate)を分画遠心し,超遠心(100,000 x g, 1 h以上)で初めて沈殿する膜分画のことである。細かく破砕されて再び閉じた小胞体膜が最も多く含まれるが,ゴルジ体など他の細胞小器官も多く含まれるので,無論同義ではない。 |
| 植物の微小管 |
|---|
| 【microtubule in plants】 |
| 村田 隆 |
| 基礎生物学研究所 生物進化研究部門 |
| お問合せ |
植物細胞の微小管はその構築様式に特徴を持つ。第一の特徴は細胞周期の進行にともなって様々な構造を作ることである。間期の細胞では微小管は細胞膜に沿って並ぶ(表層微小管列、cortical array)。M期が近づくと、微小管は将来の分裂面に沿って帯状に集積する(分裂準備帯、preprophase band)。紡錘体の極は収束せず、樽状の紡錘体ができる。細胞質分裂で細胞板ができる時には、微小管は細胞板を分泌するフラグモプラスト(隔膜形成体、phragmoplast)をつくる。表層微小管列は緑藻を含む多くの緑色植物に見られるが、分裂準備帯は陸上植物の体細胞、フラグモプラストは陸上植物とその近縁の藻類にのみ見られる構造である。第二の特徴は、中心体を持たず、微小管形成が細胞内の様々な場所で起こることである。表層微小管列においては既存の微小管上で新しい微小管が形成されることがわかっている。中心体の喪失は陸上植物の体細胞に見られる現象で、多くの緑藻は中心体を持つ。参考文献 |
| 微小管の重合核形成 |
|---|
| 【Microtubule nucleation】 |
| 五島 剛太 |
| 名古屋大学大学院理学研究科生命理学専攻 |
| お問合せ |
| 微小管(microtubule)はチューブリン(tubulin)の重合体である。試験管内では高濃度のチューブリンとGTPを混ぜると重合反応が起きて微小管が容易に生み出されるが、細胞内では通常、チューブリンは高濃度では存在せず、偶発的な重合反応が起こることは稀である。重合の際に律速となっているのは最初の段階(=重合核の形成)である。いったんチューブリンの重合が開始されると(=重合核が形成されると)、チューブリンは低濃度でも効率よく次々と付加されて微小管は伸長する。微小管の重合核形成因子としては、γチューブリン複合体(γ-tubulin complex)が知られている。試験管内でγチューブリン複合体と低濃度のチューブリンを混ぜると微小管は効率よく生み出される。細胞内では、たとえばγチューブリン複合体が多く集積している中心体では、絶え間なく微小管が生み出されている。一方、細胞内に存在するγチューブリン複合体の大半を除去してもなお一部の微小管は作り出されることから、γチューブリン複合体とは別の重合核形成因子(nucleator)が存在することも示唆されている。 なお、筆者は「重合核形成」という言葉を用いているが、「nucleation」に対する日本語訳は定まっていない。実際の日常会話では日本語でもたいていそのまま「Nucleation(ヌクリエーション)」と言っている。 参考文献 |
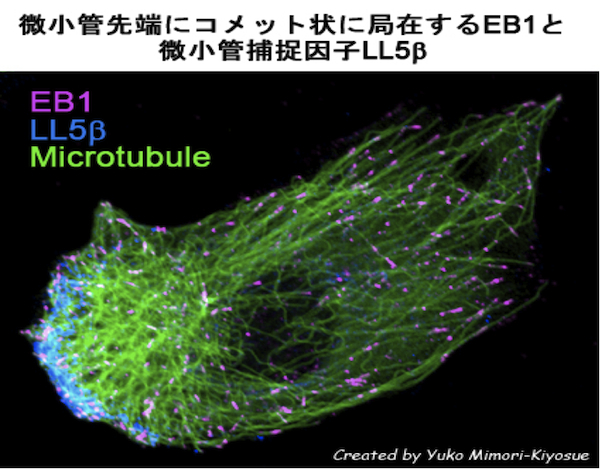
| 微小管プラス端集積因子(+TIPs) |
|---|
| 【Microtubule plus-end-tracking proteins (+TIPs)】 |
| 清末 優子 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
| 微小管マイナス端結合因子 |
|---|
| 【Microtubule minus-end binding proteins】 |
| 孟文 翔1・竹市 雅俊 2 |
| 1Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 2理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
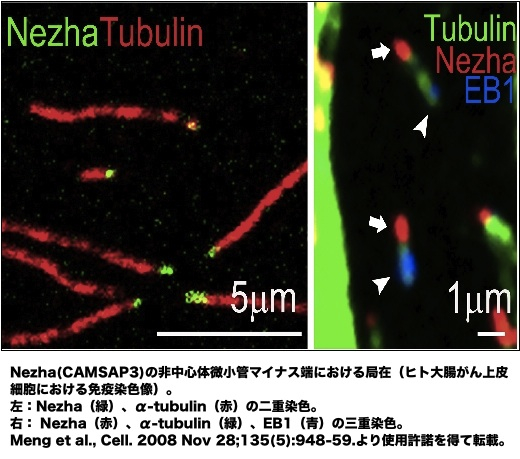
| 微小管は、プラス、マイナス両端において動的な構造体であるが、プラス端でチュ-ブリンの付加が起きやすい。この付加とマイナス端での解離がバランスされるとトレッドミル状態となることもあるが、マイナス端の脱重合速度はプラス端での重合速度よりも早いため、マイナス端が安定化されていなければ微小管は消滅する。しかし、マイナス端が何らかの形で安定化されると、微小管はブラス端だけで重合・脱重合を繰り返す[1, 2]。これが通常、細胞内でみられる微小管の状態である。 マイナス端の安定化は、中心体、またはそれ以外の細胞内構造(または分子)との結合によってもたらされ、それに対応して、微小管は中心体微小管、非中心体微小管とに分類される[2]。中心体では、γチューブリンがγ-チューブリン複合体蛋白質(γ-tubulin complex components, GCPs)と共にγチューブリン環複合体(γ-tubulin ring complex, γTuRC)を形成する。γTuRCは微小管マイナス端をキャップして安定化することで、プラス端における持続的な伸長/短縮ダイナミクスの繰り返しを可能とする。中心体は、さらに多数の成分を含み、微小管形成中心(microtubule organizing center, MTOC)としての役割を果たす[3-6]。哺乳類の細胞では、ninein、CEP192、CG-NAPとpericentrin などがγTuRCの機能を支え、これらの分子が欠損すると微小管の伸長が障害される[7-10]。 非中心体微小管は 上皮細胞、筋繊維、神経軸索等において顕著で、また、高等植物細胞はそもそも中心体を持たない。ゴルジ体、核膜、細胞膜等の構造体から非中心体微小管のプラス端重合が始まることが知られているが、その詳細な分子機構については未解明な部分が多い(繊毛微小管は、中心小体から成る基底小体から発するので、中心体微小管の一様式とみなすべきであろう)[2]。最近、微小管マイナス端結合因子Nezha(CAMSAP3)が同定され、非中心体微小管形成機構研究は新しい局面を迎えている。Nezhaは、接着結合(adherens junction, AJ)、及び、細胞質に分布し、微小管のマイナス端に結合してプラス端側の自由な伸長を支える(画像)。細胞接着部位では、Eカドヘリン-p120カテニン- PLEKHA7複合体にNezhaが結合することで微小管をAJにつなぎとめ、Nezha欠失によりAJが障害される[11, 12]。ショウジョウバエにはNezha 類似分子 Partronin(SSP4)があり、これが欠失すると細胞分裂時の紡錘体が縮小する。Partroninはマイナス端に結合することにより、キネシン13による微小管脱重合を阻害する[13, 14]。これは、Nezha/Patroninによる非中心体微小管の安定化機構をよく説明している。 またデスモソームにおいては、構成成分デスモプラキンに中心体から遊離したnineinが結合し、これが微小管をデスモソームにつなぎとめるという報告もあり、微小管マイナス端結合タンパク質が必要に応じて多様な細胞内構造に再配置される例が見つかってきている[15]。 参考文献1. Kollman, J.M., Merdes, A., Mourey, L., and Agard, D.A. Nature reviews Molecular cell biology 12:709-721 (2011)
2. Keating, T.J., and Borisy, G.G. Biol Cell 91:321-329 (1999) 3. Kollman, J.M., Polka, J.K., Zelter, A., Davis, T.N., and Agard, D.A. Nature 466:879-882 (2010) 4. Wiese, C., and Zheng, Y. Curr Opin Struct Biol 9:250-259 (1999) 5. Wiese, C., and Zheng, Y. Nat Cell Biol 2:358-364 (2000) 6. Murphy, S.M., Preble, A.M., Patel, U.K., O'Connell, K.L., Dias, D.P., Moritz, M., Agard, D., Stults, J.T., and Stearns, T. Mol Biol Cell 12:3340-3352 (2001) 7. Delgehyr, N., Sillibourne, J., and Bornens, M. J Cell Sci 118:1565-1575 (2005) 8. Gomez-Ferreria, M.A., Rath, U., Buster, D.W., Chanda, S.K., Caldwell, J.S., Rines, D.R., and Sharp, D.J. Curr Biol 17:1960-1966 (2007) 9. Takahashi, M., Yamagiwa, A., Nishimura, T., Mukai, H., and Ono, Y. Mol Biol Cell 13:3235-3245 (2002) 10. Zimmerman, W.C., Sillibourne, J., Rosa, J., and Doxsey, S.J. Mol Biol Cell 15:3642-3657 (2004) 11. Meng, W., Mushika, Y., Ichii, T., and Takeichi, M. Cell 135:948-959 (2008) 12. Akhmanova, A., and Yap, A.S. Cell 135:791-793 (2008) 13. Goodwin, S.S., and Vale, R.D. Cell 143:263-274 (2010) 14. Gardner, M.K., Zanic, M., Gell, C., Bormuth, V., and Howard. Cell 147:1092-1103 (2011) 15. Lechler, T., and Fuchs, E. J Cell Biol 176:147-154 (2007) |
| 微小管切断因子 |
|---|
| 【Microtubule Severing Factor】 |
| 岡田 康志 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| 微小管切断因子(microtubule severing factor)とは、微小管を中途で切断する活性を持つ酵素である。椎名らの実験により細胞周期依存的な微小管切断活性の存在が示唆され、現在までに4種類の微小管切断酵素が同定されている。このうちEF1α以外の3種の蛋白は、膜輸送に関わるAAA蛋白VPS4と類縁で、katanin, spastin, fidgetin と名付けられている。このうちkataninは、分裂期細胞質中の微小管切断活性因子として同定され、日本語の刀に因んで命名された。Spastinおよびfidgetinは、それぞれ神経系の変異であるヒトの遺伝性痙性対麻痺(hereditary spastic paraplegia)およびマウスの自然変異体であるfidget(モジモジするという意味)の原因遺伝子として同定され、それぞれin vitroあるいはin vivoでの微小管切断活性が確認された。 変異体の解析により、これらの微小管切断因子は、細胞分裂における微小管の長さ・量の制御や、植物細胞の間期微小管の枝分かれ構造の形成・維持、線毛の調節、神経細胞での微小管の制御などの多様な機能を果たしていることが知られている。 VPS4自体には微小管切断活性は報告されていないが、リング状の12量体を形成して膜輸送蛋白複合体を解体する機能が知られている。リング状の6量体を形成するKataninやSpastinも、これと同様の機構で微小管を解体・切断すると提唱されている。 参考文献 |
| 微小管不安定化因子 |
|---|
| 【Microtubule Destabilizer】 |
| 岡田 康志 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| 微小管(microtubule)は動的なポリマーで、その構成タンパクであるα/β チューブリン(tubulin)のヘテロ二量体の重合と解離により伸長(growth)と短縮(catastrophe)を繰り返す(動的非平衡性dynamic instability)。細胞内には、多数の伸長を促進する因子と短縮を促進する因子の双方が存在しており、組織や細胞あるいは細胞周期などに応じて微小管のダイナミクスが調節されている。このうち前者を微小管安定化因子(microtubule stabilizer)、後者を微小管不安定化因子(microtubule destabilizer)あるいは微小管崩壊因子(microtubule catastrophe factor)と総称している。
これまで3種類の異なるタイプの微小管不安定化因子が知られている。 1つは、微小管をその途中で切断する酵素で、微小管切断因子(microtubule severing factor)と呼ばれている。カタニン(katanin, 日本語の刀にちなんで名付けられた)がその代表である。 2つめのタイプは、微小管の端に局在し、端からの脱重合を促進する酵素で、微小管脱重合因子(microtubule depolymerizing factor)と呼ばれている。モータータンパク質(motor protein)のキネシン(kinesin)の一種であるkinesin-13 (M型キネシン、マウスのKIF2やヒトのMCAKなど)や、kinesin-8 (出芽酵母のKip3 など)が代表である。 3つめのタイプは、チューブリン二量体に高い親和性で結合することで微小管の重合脱重合の動的平衡を脱重合側へ移動する蛋白(チューブリン隔離因子, tubulin sequestering factor)で、スタスミン(stathmin, OP18)が代表である。ただし、結晶構造の比較などから、スタスミンもkinesin-13と同様の微小管端での脱重合促進活性を持つと考えられている。 また、微小管の重合を阻害する薬剤のコルヒチン(colchicine)やノコダゾール(nocodazole)なども、微小管不安定化因子と呼ばれることがある。 参考文献 |
| 分子モーター |
|---|
| 【Molecular Motor】 |
| 岡田 康志 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| 分子モーターとは、動きを作り出す生体分子の総称である。多くの場合、化学的エネルギーを力学的仕事に変換することで動きが作り出される。分子モーターとして特によく研究されているのが、細胞骨格系の上を動く分子モーターである。アクチン線維(F-actin)の上を動くミオシン(myosin)がその代表で、筋肉の運動をはじめ様々な生体運動に関わっている。また、微小管(microtubule)の上を動く軸糸ダイニン(axonemal dynein)は、真核細胞の線毛・鞭毛の運動を担うモーターである。キネシン(kinesin)や細胞質ダイニン(cytoplasmic dynein)も微小管上を動く分子モーターで、細胞分裂や細胞内の物質輸送、細胞内小器官の輸送や位置固定などを行っている。これらはいずれも、アデノシン三リン酸(ATP)をアデノシン二リン酸(ADP)に加水分解する酵素で、この反応によって得られる化学エネルギーを力学的仕事に変換することで運動を作り出す。
一方、バクテリアの鞭毛は細胞膜内外の電気化学ポテンシャル(H+やNa+の濃度勾配)を利用して回転運動を作り出すモーターにより駆動されている。ATP合成酵素のFoサブユニットも同様の機構で回転すると考えられている。ATP合成酵素のF1サブユニットは、Foサブユニットの回転を利用してATPを合成する酵素だが、その逆反応としてATPをADPに加水分解することでF1サブユニット自体が回転運動を作り出すことができる。 さらに、細胞骨格自体も、化学反応と共役した伸長・短縮を繰り返すことで力学的仕事を行っている。たとえば、細胞膜直下でのアクチン線維の重合は細胞膜伸展の駆動力であると考えられている。また、染色体の微小管の短縮に共役した輸送も知られている。 更に最近では、DNAやRNAの重合や修飾を行う酵素も分子モーターとしての活性を持つことが示されている。たとえば、DNAポリメラーゼ(polymerase)やRNAポリメラーゼ、あるいはリボソームは、DNAやRNAの重合、蛋白の翻訳に伴って鋳型DNA/RNAの上を移動する。ヘリケース(helicase)はDNA二本鎖を解離しながら移動し、ウイルスにはDNAをウイルスのカプシド(capsid)内に押し込むためのpackaging enzymeが存在する。さらに、クロマチン・リモデリング(chromatin remodeling)や、染色体形成(chromosome condensation)も力学的仕事を伴う過程だが、やはりATPの加水分解をエネルギー源とするモーター分子(SWI/SWF, SMCなど)が関与している。 ユニークな分子モーターとしては、ピエゾ素子のように電位依存的に内耳外有毛細胞を高速に伸縮させることで聴覚の感度調節を司るprestinがある。 参考文献 |
| 膜ナノチューブ |
|---|
| 【membrane nanotubes】 |
| 大野 博司 |
| 理化学研究所・横浜研究所 免疫アレルギー科学総合研究センター(RCAI) |
| お問合せ |
樹状細胞、T細胞などの免疫系細胞に見られる細胞構造。異なる二つ以上の細胞をつなぐチューブ構造であり、細胞膜から形成される。直径が数十〜数百ナノメートルの比較的細い物から、数マイクロメートルの太い構造が確認されている。細胞内カルシウムシグナルの細胞間伝播に働く、とともに、異常プリオン、HIVウィルスそれ自身もしくはウィルス由来の病原性蛋白質の細胞間伝播に関わると考えられている。他にtonneling nanotubes (TNTs), Cytoemes とも記載される。図はRaw264.7細胞の細胞膜を染色した図。細胞同士をつなぐ細長いチューブ構造が確認できる。参考文献Nat. Rev. Mol. Cell Biol. 9 (6): 431?6., Histochem. Cell Biol. 129 (5): 539?50. |
| 膜結合型細胞増殖因子 |
|---|
| 【Membrane-anchored growth factors】 |
| 目加田 英輔 |
| 大阪大学微生物病研究所細胞機能分野 |
EGFファミリーを含むある種の増殖因子やサイトカインは膜結合型として合成される。EGFファミリー以外ではTNF (tumor necrosis factor)-a, c-kit ligand/stem cell factor, CSF (colony stimulationg factor)-1, IL (interleukin)-1, ephrin-B等が膜型として合成されることが知られている。これらの中には膜型でないと正常な機能を示さない因子もある。例えばc-kit ligandでは分泌型は合成できるが膜型を合成できない変異マウスは発生異常を呈することや、ephrin-Bの場合では分泌型に変異させるとその活性が失われること等が報告されている。反対に、ショウジョウバエのSpitz(ヒトTGF-aのホモログ)では膜型では不活性で分泌型が活性型であると考えられている。さらにTNF-aでは膜型と分泌型で異なる受容体に結合するという報告もあり、その作用様式は多様である。参考文献Cytokine Growth Factor Rev. 11: 335-344. 2000 |
| 膜交通と小胞輸送 |
|---|
| 【membrane traffic】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| 真核細胞の細胞小器官(organelles)のうち単膜系のもの,つまり,小胞体(核膜を含む),ゴルジ体,リソソーム/液胞,分泌小胞/分泌顆粒,エンドソームなどは,もともと細胞膜が細胞質内に陥入したことにより生じた細胞内膜系(endomembrane system)に属し,細胞膜を含めた複雑な膜交通(membrane traffic)のネットワークを形成している。細胞小器官の間のタンパク質輸送は,小胞(vesicles)が介在することが多いので小胞輸送(vesicular transport)とも呼ばれるが,細胞小器官同士の直接の接触や細管(tubules)の連絡でも輸送は可能であり,それらをひっくるめて膜交通(membrane traffic)と総称することが多くなった。業界では親しみを込めて「メントラ」と略称される。なお,膜輸送という言葉は,膜透過を意味する場合に使われることが多いので,混乱を避ける意味でも区別して使いたい。 |

 HOME
HOME