- ホーム
- >
- 細胞生物学用語集トップ
- >
- 細胞生物学用語集【P-T】
細胞生物学用語集【P-T】
【P】
| PAR-aPKC システム |
|---|
| 【PAR-aPKC system 】 |
| 鈴木 厚 |
| 横浜市立大学大学院医学研究科 分子細胞生物学 医学部分子生物学教室 |
| お問合せ |
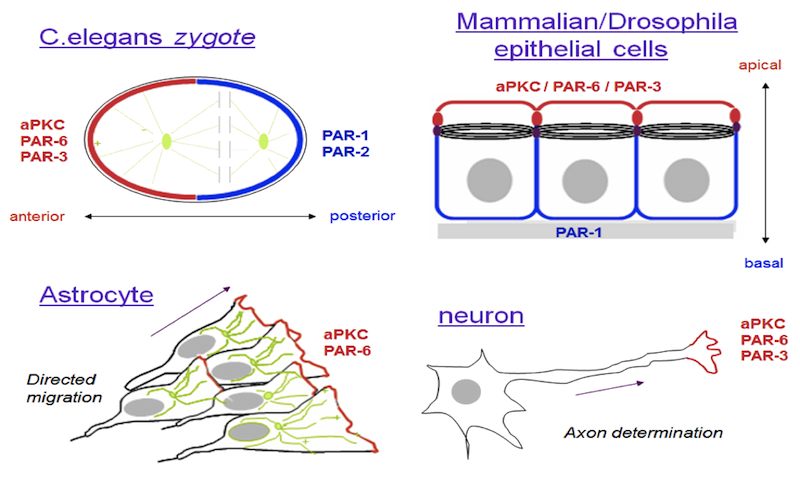
| atypical PKC、および6種のPARタンパク質(PAR-1〜PAR-6)で構成される、種を超えて存在する普遍的細胞極性制御シグナル伝達システムを指す(線虫以外ではPAR-2に相当するタンパク質はいまだ同定されていない)。
細胞分化や幹細胞維持に必要な細胞の非対称分裂、さらには、分化を終えた上皮細胞や神経細胞の形態、機能の非対称化・極性化にも必須な機能を発揮している。多細胞生物の誕生とともに出現したシステムと考えられ、多細胞個体の複雑な形態形成と細胞特異的な機能獲得を可能にする上で、重要な役割をはたしてきたと推測される。 細胞内外からの極性シグナルに応答して、システム内のタンパク質間の相互作用にが生じ、細胞膜直下においてaPKC/PAR-3/PAR-6複合体とPAR-1が相互排除的に分布し、そのことによってまず、非対称な膜ドメインを確立される。その後に、それぞれの因子(特に、aPKC, およびPAR-1といったセリン・スレオニンキナーゼ)が細胞骨格系や細胞内輸送系を制御することによって細胞全体の非対称化が引き起されると考えられる。 参考文献A. Suzuki & S. Ohno The PAR-aPKC system: lesson in polarity. J. Cell Sci. 119: 979-987 (2006) 鈴木 厚、大野茂男, 細胞工学 24(3)、 「aPKC/PARシステム:多細胞生物の細胞極性を普遍的にコントロールする分子制御装置」227-230, 秀潤社, 2005 |
| チューブリンの翻訳後修飾 |
|---|
| 【Post-translational modifications of tubulin】 |
| 池上 浩司 |
| 浜松医科大学 医学部 解剖学講座 |
| お問合せ |
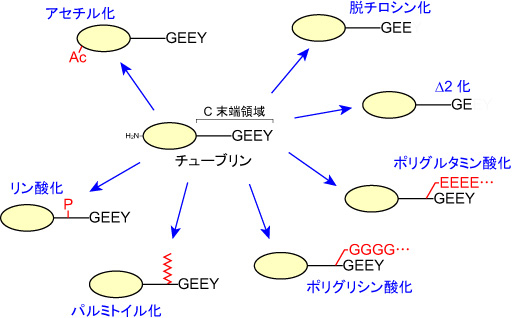
チューブリン(tubulin)は、アセチル化(acetylation)、リン酸化(phosphorylation)、パルミトイル化(palmitoylation)、脱チロシン化(detyrosination)、Δ2化、ポリグルタミン酸化(poly-glutamylation)、ポリグリシン化(polyglycylation)などの翻訳後修飾を受ける。アセチル化以外の修飾は、微小管(microtubule)表面に位置するチューブリンC末端領域に集中し、微小管表面の多様性を生み出す。修飾による微小管表面の多様性は、微小管と微小管結合タンパク質(MAPs)との相互作用に強い影響を与え、微小管の安定性や分子モーターの移動先などを制御する。参考文献 |
| プロフィリン |
|---|
| 【Profilin】 |
| 渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
12-15 kDのアクチンモノマー結合タンパク質。細胞質に豊富にある。単量体アクチンのADP-ATP交換反応を加速するとともに、ATP結合単量体アクチンに強く結合する(解離定数 〜0.1 μM)。プロフィリンに結合したアクチンは、速い重合端であるアクチン線維の反矢じり端(barbed end)に単量体アクチンと同様の速さで付加されるため、プロフィリンはアクチン伸長を助けるが、アクチン重合核の形成に対しては阻害的に働く。また、平衡状態のアクチン線維では脱重合端となる矢じり端(pointed end)への重合は阻害する。プロフィリン-アクチン複合体は、細胞質に10〜40 μM存在し、迅速な線維伸長を可能とする。また、アクチン伸長端に結合するフォルミンファミリータンパク質やEna/VASPタンパク質のポリプロリン配列に結合することで、協調して線維伸長を数倍加速する。インビトロでは、ADPアクチンの線維の反矢じり端からの脱重合を促進することも知られている。ホスファチジルイノシトール(4, 5)二リン酸などのホスホリピッドに結合するとアクチンとの相互作用が弱まる。参考文献 |
| リン脂質とアクチン細胞骨格 |
|---|
| 【Phospholipids and actin cytoskeleton】 |
| 伊藤 俊樹 |
| 神戸大学大学院医学研究科 |
アクチン細胞骨格は、負に帯電した細胞膜の直下において機能することから、酸性脂質(主にリン脂質)による直接的な制御を受けるのではないかと考えられてきた。実際、試験管内において、イノシトールリン脂質PIP2を含む人工膜小胞(リポソーム)をカエル卵抽出液中に添加すると、「アクチンコメット」と呼ばれる重合体を形成しながら運動する様子が観察される。これはリン脂質が直接アクチンの重合を促進する証拠であるが、この現象には多数のアクチン結合/調節タンパク質が関与している。profilin、cofilin、gelsolin、α-actininなどの直接アクチン線維の形成に作用するタンパク質を始め、ERMタンパク質、talin、vinculinなどの細胞膜との接触点に関与するタンパク質、N-WASPやWAVEなどのArp2/3複合体の活性化因子に至るまで、非常に多岐に渡るアクチン調節タンパク質がリン脂質と直接結合し、その機能制御を受けることが知られている。一般的に、リン脂質との結合はアクチン重合因子の活性を促進し、逆にアクチン重合を阻害する因子やアクチン線維を切断する因子に対しては阻害的に作用する傾向がある。参考文献 |
| 原形質と後形質 |
|---|
| 【protoplasm】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| 原形質はprotoplasm,後形質はmetaplasm。前者は細胞の中の「生きている」部分,後者は原形質の活動によって後から作られた「生きていない」部分,というのがもともとの定義であった。後形質としては,たとえば植物の細胞壁や液胞がそうであるとされたが,今となってはこれが全くナンセンスであるのは明らかだろう。細胞壁や液胞も立派な生命活動の場なのだから。顕微鏡による細胞内微細構造の知識もなかった時代に使われた言葉であり,今では死語となったと考えるべきである。しかし,その派生語としては現在も使われるものが少なくない。たとえば,原形質流動(cytoplasmic streaming),原形質連絡(plasmodesmata),原形質糸(transvacuolar strands)など,植物分野でよく生き残っているように思われる。ただ,これも英語の方を見てもらえばわかるように,protoplasmという表現はもうほとんど使われていない。唯一,英語でもなごりが残るのがprotoplastsという言葉。プロトプラストとは,細胞壁を酵素処理して除き,細胞膜が露出した状態の細胞のことであり,これは現在でも頻繁に使われる。酵母では,同様に細胞壁を除いた細胞のことをスフェロプラストと呼ぶが,これは酵素処理しても細胞壁成分が完全には除き切れていないから。 |
| 細胞膜と形質膜 |
|---|
| 【plasma membrane】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| 細胞膜は,plasma membraneあるいはplasmalemmaの日本語訳である。より直訳に近い形質膜という言葉も使われるが,細胞膜がすでに長年定着している。ときとして,cell membranesという一般的な語の訳として用いられ,生体膜全般を意味するような用法を見ることがあるが,大きな混乱を招くのでこれは避けるべきだろう。 |
| 植物ミオシン |
|---|
| 【plant myosins】 |
| 山本 啓一 |
| 千葉大学理学部生物学科 |
| お問合せ |
現在、ミオシンは二十数種に分類されているが、植物で働いているのはVIII型とXI型である。XIII型というミオシンがカサノリから発見されたがそれはXI型の一種と見なされることになった。VIII型は原形質連絡の開閉やエンドサイトーシスに関与し、XI型はオルガネラの輸送とそれに伴う原形質流動に関与すると考えられている。植物細胞は動物細胞と比べてサイズが桁違いに大きいので、細胞内の物質循環を拡散に任せるわけにはいかず、原形質流動という細胞質の流れを起こしている。この流れは、XI型ミオシンが、小胞体膜のネットワークを引きずりながら、アクチンフィラメント上を滑り運動することにより引き起こされる。車軸藻の節間細胞は長さが数cmもあり、その中では毎秒70マイクロメーターという速い原形質流動が起こっている。この流速は車軸藻ミオシンがアクチン上を動く速度そのものなので、車軸藻ミオシンは筋肉ミオシンの10倍以上の速さで動くことのできる世界一速いモータータンパク質と言える。動かない植物のミオシンが、動くことが特徴である動物の筋肉ミオシンより速いというのはどのような意味があるのだろう。実は、この速さゆえ、車軸藻ミオシンがATPの化学エネルギーを運動に変換する効率は低く、出せる力は筋肉ミオシンと比べるとかなり小さい。原形質流動を引き起こす力はあまり強くなくて良いので、車軸藻ミオシンはエネルギー変換効率を犠牲にして巨大細胞内での物質輸送の速さを追求したものと考えられる。モデル植物のシロイヌナズナにはVIII型ミオシン遺伝子が4、XI型ミオシン遺伝子が13存在する。シロイヌナズナXI型ミオシン遺伝子を1−2個ノックアウトしてもオルガネラの輸送速度や表現系に大きな変化は見られないので、ミオシン間で機能の重複があるようだ。推定される細胞内での役割と対応するように、VIII型ミオシンの酵素活性や運動活性はXI型ミオシンより低い。
参考文献Yamamoto, K.(2008) "Plant Myosins" Chapter 12 in "Myosins" Ed. by L. M. Coluccio Springer Netherlands Ito,K., Kashiyama, T., Shimada, K., Yamaguchi, A., Awata, J., Hachikubo,Y., Manstein, D. J., and Yamamoto, K. (2003) Biochem Biophys Res Commun, 312, 958-964. Yamamoto, K., Shimada, K., Ito, K., Hamada, S., Ishijima, A., Tsuchiya, T. and Tazawa, M. (2006) Plant Cell Physiol. 47, 1427-1431. 山本研究室ホームページ |
| 非筋ミオシンIIの分子種の特徴 |
|---|
| 【Properties of nonmuscle myosin II isoforms】 |
| 高橋 正行 |
| 北海道大学大学院理学研究院 |
| お問合せ |
非筋ミオシンII(nonmuscle myosin II)は、アクチンフィラメントを動かす、或いはつなぎ止めることで、細胞の形態変化を含む様々な過程(細胞質分裂、細胞遊走、細胞間及び細胞−基質間接着等)に関与するモータータンパク質である。二本ずつの重鎖(myosin heavy chain:MHC)、必須軽鎖(essential light chain)、調節軽鎖(regulatory light chain)からなる六量体であり、二個の球状の頭部と長い棒状の尾部をもつユニークな構造をもつ。頭部は、 ATPase活性部位とアクチン結合部位を含むモータードメインと,軽鎖結合部位であるレバーアームからなり、アクチンフィラメントを動かすモータータンパク質としての機能を担う。尾部はミオシンIIが会合して双極性のフィラメントを形成することに関与する。ミオシンIIはフィラメントを形成して機能することにより、複数のアクチンフィラメントを同時につなぎ止める構造タンパク質としての役割も持つ。ほ乳類には三種類のミオシンII重鎖アイソフォーム(MHC-IIA,-IIB,-IIC)が存在し,それぞれがホモダイマーを形成してミオシンIIA,IIB,IICとなる。さらに、IIBとIICには頭部のLoop1(ATPase site 近傍)及びLoop2(アクチン結合部位近傍)に短い挿入配列をもつスプライスバリアント、B1、C1及びB2、C2が存在する。B1、B2、C2は神経組織特異的に発現している。IIAのノックアウトマウスは、近位内胚葉層形成の異常と細胞間接着の欠陥により胎生6.5日目で死亡する。IIBのノックアウトマウスは、その発現が多い組織である脳と心臓に発生異常が起こり、ほとんどが胎生14.5日目で死亡する。IIAは他のアイソフォームよりも高いモータータンパク質としての活性を示す。IIBは他のミオシンIIと比べて異常に高いduty ratio (1回のATP加水分解サイクルにおけるアクチンに結合している時間の割合)を示すことから、構造タンパク質としての役割が強い可能性もある。一方、IICは全ヒトゲノム塩基配列決定後、新たにその存在が明らかになったアイソフォームであるが、そのノックアウトマウスに顕著な異常は見られない。それぞれのアイソフォームにおいて、組織特異的な発現様式、また細胞内局在の違いも報告されており、重複した機能の他にアイソフォーム特異的な機能があることが考えられる。参考文献 |
【R】
| Rhoファミリー低分子量Gタンパク質による細胞骨格の制御 |
|---|
| 【Regulation of cytoskeletons by Rho family small GTPases】 |
| 遠藤 剛 |
| 千葉大学大学院理学研究科 |
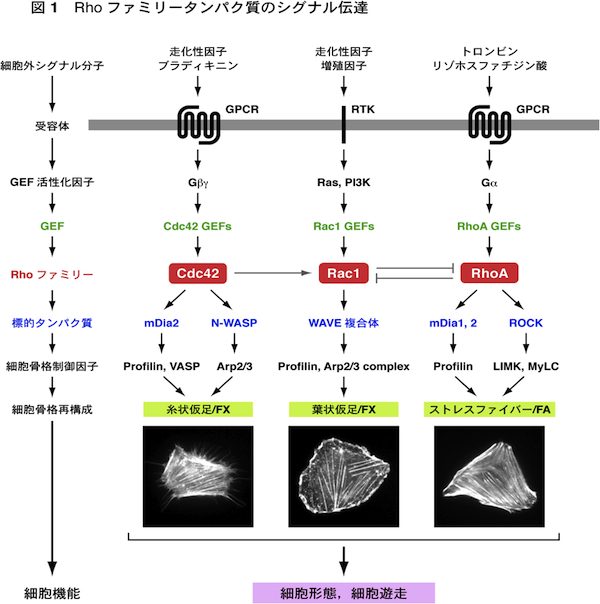
| 細胞内のアクチン細胞骨格と微小管はダイナミックに変化するが,その制御の中心的な役割を担っているのがRhoファミリー低分子量Gタンパク質である.哺乳類ではRhoファミリータンパク質は約20存在するが,これらのうちで特にRhoA, Rac1, Cdc42についての研究が進んでいる.これらはいずれも,細胞外のシグナル分子とそれらの受容体により活性化されたGDP/GTP交換因子(GEF)が作用して活性化される.すなわち,GDPを結合した不活性化状態からGTPを結合した活性化状態に変換される.活性化されたRhoファミリータンパク質は,標的タンパク質(エフェクタータンパク質)に結合して作用を現す.またGTPを結合したRhoファミリータンパク質にGTPase活性化タンパク質(GAP)が作用すると,GTPase活性が促進されてGTPを加水分解し,GDPを結合した不活性化状態にもどる. Cdc42は標的タンパク質のmDia2やN-WASPを介して,束状のアクチン線維を形成し,糸状仮足(filopodia)の形成を引き起こす.またRac1は標的タンパク質のWAVE複合体を介して,枝分かれしたアクチン線維のネットワークを形成し,葉状仮足(lamellipodia)の形成に働いている.RhoAは標的タンパク質のmDia1を介してアクチン線維を形成し,またROCK(Rhoキナーゼ)を介してアクチン・ミオシン相互作用を引き起こす.これによりストレスファイバーとフォーカルアドヒージョン(接着斑)の形成がもたらされる.走化性因子に向かって細胞が遊走する場合には,細胞前方(先導端)に形成される糸状仮足が走化性因子を含む細胞周辺の環境を探り,また葉状仮足が細胞体の移動に働く.さらにストレスファイバーが細胞後方(尾部)の退縮に働く.こうしてCdc42, Rac1, RhoAが時空的に協調して働くことにより,細胞遊走がもたらされる. 遊走している細胞は前方が広がった扇状の形態をとる.このような細胞では,核の前方に微小管形成中心(MTOC)が配置して,そこから微小管が伸長・短縮している(動的不安定性).微小管が伸長するプラス端は細胞前方に配向し,アクチン線維やフォーカルアドヒージョンに結合すると安定化する.Cdc42とRac1は標的タンパク質のPar6, IQGAP1, PAKを介して,核前方へのMTOCの配置,および微小管の安定化や細胞膜への結合に働く.またRhoAもmDia1, mDia2を介して微小管の安定化に働く.このようにCdc42, Rac1, RhoAは遊走細胞の極性(方向性)の形成にもかかわっている. 参考文献(1) 渡邊晴子,高野和儀,遠藤 剛 (2006) 蛋白質 核酸 酵素 増刊「細胞骨格と接着」,51, 683-692.
(2) Jaffe, A.B., Hall, A. (2005) Annu. Rev. Cell Dev. Biol. 21, 247-269. (3) Rottner, K., Stradal, T.E. (2011) Curr. Opin. Cell Biol. 23, 569-578. |
| RNAの輸送 |
|---|
| 【RNA transport】 |
| 椎名 伸之 |
| 基礎生物学研究所・神経細胞生物学研究室 |
| お問合せ |
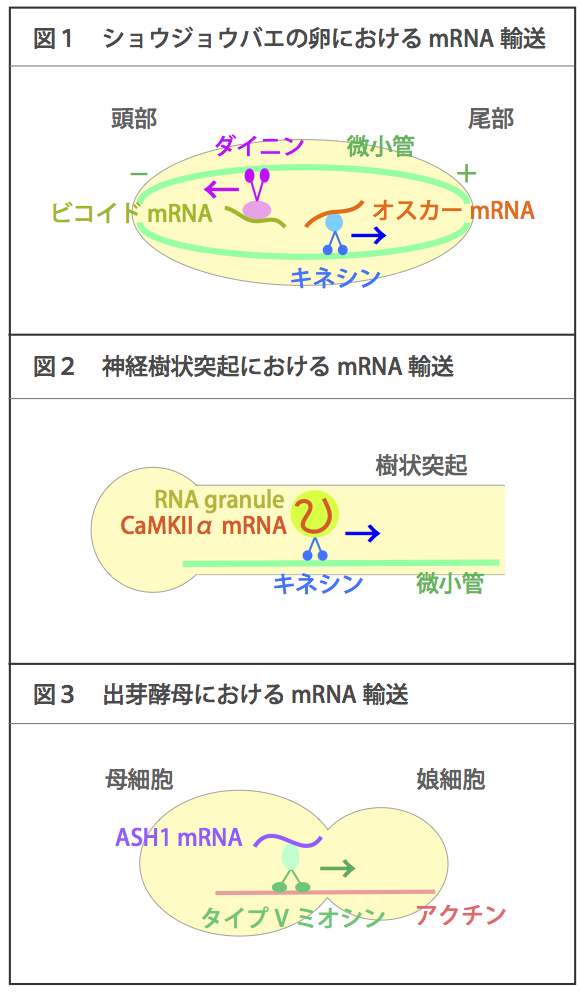
| 微小管やアクチン細胞骨格をレールとして、特定の種類のmRNAが輸送される。微小管をレールとした場合にはキネシンやダイニンをモータータンパク質として用い、アクチンをレールとした場合にはタイプVミオシンをモータータンパク質として用いることが知られている。mRNA輸送によって、細胞内の局所でタンパク質を合成して機能させることができる。 例えばショウジョウバエの卵では、微小管のマイナス端は頭部側を、プラス端は尾部側を向いて形成されている。ビコイドmRNAはダイニンによってマイナス端すなわち頭部側へ輸送され、オスカーmRNAはキネシンによってプラス端すなわち尾部側へ輸送される(図1)。頭部、尾部にそれぞれ係留されたmRNAから局所的にタンパク質が合成される結果、タンパク質局在に濃度勾配ができる。その濃度勾配は、頭部と尾部の体軸形成に必須である。 神経細胞の樹状突起では、カルモジュリンキナーゼIIα(CaMKIIα) mRNAなどが微小管をレールとしてキネシンによって輸送される。この際mRNAはRNA granuleと呼ばれる巨大複合体に取り込まれて輸送されることが知られている(図2)。mRNAはシナプス刺激入力に応じて局所的に翻訳され、局所シナプスの選択的な長期増強、ひいては記憶や学習に関与する。 また、出芽酵母では、ASH1 mRNAがアクチンをレールとしてタイプVミオシンによって母細胞から娘細胞へ輸送される(図3)。その結果、ASH1 mRNAおよび翻訳産物は娘細胞にのみ局在し、母細胞と娘細胞の運命(接合型)は異なったものになる。 参考文献 |
| RNA局在 |
|---|
| 【RNA localization 】 |
| 入江 賢児 |
| 筑波大学大学院人間総合科学研究科(基礎医学系)分子細胞生物学グループ |
| お問合せ |
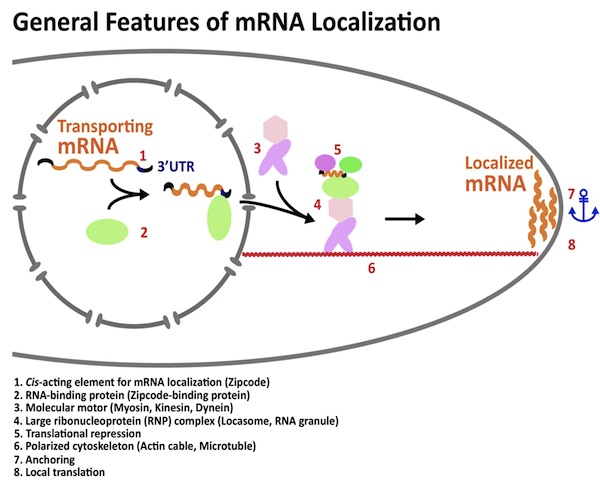
| 「RNAの局在化」とは、核内で転写されたRNAが細胞内の特定の場所に存在する現象です。RNAの局在化により、細胞内では情報の偏りが生じ、細胞の極性が生まれます。生物の遺伝情報は、遺伝子の本体であるDNAからRNAに写し取られて発現します。そのため、RNAの局在化は、遺伝子発現を空間的に制御するための重要な現象です。図の説明 (1) 局在化するmRNAはジップコードと呼ばれる局在化シグナルをもっている。ジップコードはmRNAの3’非翻訳領域に見られることが多い。
(2) ジップコードにRNA結合タンパク質が結合する。 (3) ミオシンやキネシンなどの分子モーターがRNA局在に使われる。 (4) mRNAとRNA結合タンパク質は分子モーターとともに、巨大なRNA-タンパク質複合体を形成する。 (5) 輸送されるmRNAの翻訳は抑制されることが多いので、巨大なRNA-タンパク質複合体には翻訳の抑制因子が含まれる。 (6) RNA-タンパク質複合体はアクチンケーブルや微小管などの極性化した(方向性をもった)細胞骨格上を輸送される。 (7)と(8) 輸送されるmRNAは局在化部位に係留され、そこで局所的に翻訳される。 参考文献1;Moving messages: the intracellular localization of mRNAs. St Johnston D. Nat Rev Mol Cell Biol. 2005 May 6(5):363-75. |
| RNA制御 |
|---|
| 【RNA regulation】 |
| 入江 賢児 |
| 筑波大学大学院人間総合科学研究科(基礎医学系)分子細胞生物学グループ |
| お問合せ |
遺伝情報はDNAからRNAを経てタンパク質として発現される。 生物の持つ複雑で巧妙な形態・機能の獲得には、RNA段階での 遺伝子発現制御プログラムが重要な役割を果たす。すなわち、 個体発生の過程において、様々な「1.非対称性制御プログラム」 により、単一の受精卵から非対称な細胞群が生成され、「2.多様 性獲得プログラム」(選択的スプライシング)により、分化過程で 形成される細胞が担う多様な機能の獲得に必要な遺伝子産物 自体の多様性が獲得される。さらに、「3.品質保証プログラム」 による厳密な監視により、RNAレベルでの制御の正確性が保証される。
参考文献1;蛋白質核酸酵素 2009年12月増刊号 mRNAプログラム。 |
| コフィリンによるアクチン骨格の制御 |
|---|
| 【Regulation of actin cytoskeleton remodeling by cofilin】 |
| 大橋 一正 |
| 東北大学大学院生命科学研究科 |
| コフィリンは、アクチン繊維を切断・脱重合する活性をもつ20 kDaのアクチン結合タンパク質である。酵母から存在し、生存に必須であり、ヒトまで高度に保存されている。コフィリンは、ヒトで遺伝子の異なる筋肉型、非筋肉型、Actin depolymerizing factor (ADF)の3種類が存在する。細胞内の数μモルの濃度で存在する。試験管内の実験により、繊維状のF-アクチン, 単量体のG-アクチンどちらにも結合することが明らかとなっている。また、ADP結合型のアクチンに対してより高い親和性を持ち、ADPの加水分解とリン酸の放出が進んだ古いアクチン線維を切断・脱重合すると考えられている。アクチン繊維の脱重合と切断は異なる作用で、アクチン線維のマイナス端からアクチンの脱重合する活性と、アクチン線維の側面に結合し、アクチン線維のらせん構造をよりねじれた状態にすることで不安定化して切断する作用があると考えられている。
細胞内における基本的なコフィリンの機能は、アクチン線維を切断・脱重合しアクチン骨格の流動性を生みだす働きである。細胞内のコフィリンの発現抑制や不活性化は、細胞内アクチンの過重合により重合と脱重合のターンオーバー速度の低下を引き起こし、アクチンの流動性が失われ、細胞は全く運動できない状態になる。 コフィリンのアクチン脱重合・切断活性に対する制御は、主に、ホスファチジルイノシトール4,5ビスリン酸(PIP2)との結合によるアクチン線維への結合阻害、3番目のセリン残基のリン酸化によるアクチン結合活性の不活性化、Actin interacting protein 1 (Aip1),アデニル酸シクラーゼ結合蛋白質(CAP)との結合による活性促進の制御が知られている。コフィリンのリン酸制御は、リン酸化酵素としてLIMキナーゼファミリー(LIMK1, LIMK2, TESK1, TESK2)が働き、脱リン酸化酵素としてSlingshotファミリー(Slingshot-1, Slingshot-2, Slingshot-3)が働く。これ以外にPP1, PP2A, ハロ酸デヒドロゲナーゼの一つでタンパク質脱リン酸化酵素として働くChronophinが脱リン酸化酵素として働くことが報告されている。コフィリンのリン酸化制御は、進化的にショウジョウバエ以降で保存されており、酵母にはLIMキナーゼ、Slingshotに相同な遺伝子は存在しない。 LIMキナーゼは、 LIMK1, LIMK2共に低分子量Gタンパク質Rhoファミリーの下流エフェクターのリン酸化酵素ROCK, PAKによってリン酸化され活性化される。LIMK1は、細胞移動に必要であり、ラメリポディア形成、ストレスファイバー形成において部分的に寄与する働きを持つと考えられている。Slingshotは、Slingshot-1について解析が進んでおり、アクチン線維と結合して強く活性化されること、Rhoファミリーの一つであるRacやPI3キナーゼの下流で活性化されること、Ca2+シグナルの下流でカルシニューリンによって活性化されることが報告されている。細胞外からの刺激依存的にLIMキナーゼと共に活性化され、コフィリンのリン酸化のターンオーバーを促進することでアクチン骨格の再構築に寄与すると考えられる。 参考文献 |
| ミオシンの局在制御機構と細胞運動 |
|---|
| 【Regulation of myosin II for subcellular localization and cell motility】 |
| 祐村 恵彦 |
| 山口大学大学院医学系研究科 |
ここでは,タイプIIのミオシンIIについてのみ解説する。このミオシンは骨格筋ミオシンに似ており,双極性の繊維を形成することができる。ミオシンIIは分裂細胞では,細胞質分裂時に収縮環に,移動細胞では細胞の尾部に局在する。ミオシンIIが局在する場所でアクチン繊維との相互作用により,力を発生し細胞質分裂,移動運動,さらに形態形成などに寄与していると考えられる。ミオシンIIの遺伝子を欠損させる実験が細胞性粘菌で初めて行なわれ,この欠損細胞では,収縮環依存の細胞質分裂ができないため,多核化することが示された。これ以前に,馬淵らによる,ミオシンに対する抗体を顕微注射すると細胞質分裂が阻害されるという歴史的実験もミオシンIIが細胞内で局在してその場所で力を出すことを示している。ミオシンII欠損細胞でも移動運動は可能であるが,尾部の収縮ができず,仮足でのアクチンの重合による伸長のみにより移動運動することになり速度も遅くなる。ミオシン繊維の形成はミオシンIIの細胞内局在には必須で,繊維化できない改変ミオシンでは局在が見られなくなる。ミオシンIIの繊維の制御と酵素の活性化の制御はリン酸化に依存するが,その修飾は生物によって軽鎖もしくは重鎖,もしくは両方が関与する。ミオシンIIが収縮環や細胞尾部にどのように局在するかは,まだよく分かってない。リン酸化の酵素活性が細胞内で偏っておれば,繊維を局所に集合させることができるという考え(リン酸化勾配説),アクチンを含めた細胞膜の流れがミオシンIIを分裂面や細胞尾部に運ぶ(表層流説),anillinのようなミオシンIIを分裂面にアンカーするタンパク質がある(結合タンパク質説)などが議論されている。最近,アクチン繊維が張力センサーとして機能していて,繊維が伸ばされる時にミオシンIIがより結合しやすくなるため,張力を発生し始めた部位にミオシンIIが集合するのではないかという斬新なアイデアが提唱されている。参考文献Mabuchi, I and M. Okuno (1977). The effect of myosin antibody on the division of starfish blastomeres. J Cell Biol. 74:251-263.
PubMed Uyeda T. Q. P. et al. (2011). Stretching actin filaments within cells enhances their affinity for the myosin II motor domain. PLoS One, e26200. PubMed Yumura, S. et al. (2008). Multiple mechanisms for accumulation of myosin II filaments at the equator during cytokinesis. Traffic, 9:2089-2099. PubMed |
| リポソームと細胞骨格(アクチン、微小管、セプチン) |
|---|
| 【Reconstruction of cytoskeletons (actin, microtubule or septin) using liposome】 |
| 滝口 金吾・滝口 陽子 |
| 名古屋大学大学院理学研究科 |
| お問合せ |
| 生体膜の形態形成や動態制御の機構をインビトロの系で研究する際、膜のモデルとして巨大人工脂質膜小胞(巨大リポソーム、giant liposome、giant vesicleまたはgiant unilamellar vesicleなど)がよく使われる。巨大リポソームは、脂質二重膜(lipid bilayer、脂質二分子膜など色々な呼び方がある)が水溶液中で自然に閉じてできる人工膜小胞(liposome またはvesicle)の中でも直径がμmオーダー以上のものをそのように呼ぶ [1, 2]。細胞と同程度の大きさであり、位相差、蛍光、微分干渉、暗視野などいろいろな光学顕微鏡法で直接観察ができる利点を持つ。 巨大リポソームの作製には、試験管内に作製したリン脂質を主成分とする脂質フィルムに水溶液を加え静置して得る静置水和法(gentle hydration、natural swellingなど)や [3-5]、白金や透明導電ガラス(ITO (indium tin oxide)ガラスが多く用いられる)の表面にリン脂質を主成分とする脂質を塗布しておき、水溶液中で交流電圧を印加して作るエレクトロフォーメーション法(electro formation)が主流である [6]。最近は、界面通過法(spontaneous transfer)など、油水界面にできる脂質の単層の膜(lipid monolayer、これも脂質一分子膜など色々な呼び方がある。単層の脂質二重膜との混同に注意!)を利用して作製する新たなリポソーム作製法も開発され、より広汎な条件下、より良い効率で巨大リポソームが得られるようになってきている [7, 8]。 細胞骨格と生体膜との相互作用を見る目的で、アクチンや微小管、セプチンなどを巨大リポソームに再構成させる場合には2通りある。 1つは、巨大リポソーム内に細胞骨格蛋白質を封入し、リポソーム内部の空間で再構成させる方法である。静置水和法やエレクトロフォーメーション法でリポソームを作製する際に、重合前のG-アクチンやチューブリンを含んだ水溶液を使うと、自然に内部にG-アクチンやチューブリンを取り込んだ巨大リポソームが形成されてくる。このリポソームの形成後に温度の上昇や塩の内部供給によって、リポソームの内部でアクチン線維や微小管の重合を起こさせることができる [3, 4, 9]。また界面通過法などの手法を用いれば、既に重合してできたアクチン線維やアクチンの束もリポソーム内部に再構成することが可能である [7, 8]。 もう1つは、予め作製しておいた巨大リポソームを含む溶液に、灌流装置を用いて細胞骨格蛋白質溶液を添加することにより、リポソームの外部から相互作用させ、その表面で再構成させる方法である。セプチンの膜結合能の検証および膜突起誘導活性の発見は、この方法によって成された [5]。 リポソームの作製は容易で観察法も様々あるので、膜の研究を行う際に大変有効である。しかし、巨大リポソームに限らず、リポソームを用いて実験しようとするときには以下のことに留意する必要がある。リポソームの作製にどのような手法を用いるにしても、脂質組成や作製時の温度、溶液条件が、作製効率ならびに作製されてくるリポソームのサイズや形態に大きく影響する。特に作製時に使う水溶液が2価の陽イオンや高濃度の塩を含む場合、多層の脂質二重膜からできた膜小胞(multilamellar vesicle)や、脂質二重膜を形成仕損なった脂質分子が凝集してできた油滴(lipid droplet)などが形成されてくるので、リポソームとの混同に注意しなければならない。生理的な塩濃度など高い塩濃度条件下でリポソームを使用したり作製したりするためには、先ず等張の糖を含む溶液で作製しておいたリポソームを実験に使う、脂質組成にPEG(polyethylene glycol)を結合させた脂質を加えて作製する、界面通過法などのような手法を用いてリポソームを作製する、などの工夫が必要である [5-9]。 参考文献[1] R. Lipowsky, Nature 349, 475-481 (1991)
[2] H. Hotani et al., Biosystems 71, 93-100 (2003) [3] M. Honda et al., J. Mol. Boil. 287, 293-300 (1999) [4] T. Kaneko et al., J. Mol. Boil. 284, 1671-1681 (1998) [5] Y. Tanaka-Takiguchi et al., Curr. Biol. 19, 140-145 (2009) [6] T. Wollert & J.H. Hurley, Nature 464, 864-869 (2010) [7] K. Takiguchi et al., Langmuir 27, 11528-11535 (2011) [8] K. Takiguchi et al., Methods Enzymol. 464, 31-53 (2009) [9] L. Limozin et al., Phys. Rev. Lett. 95, 178101 (2005) |
| 中間径フィラメントのリン酸化による構築制御 |
|---|
| 【Role of phosphorylation on the disassembly of IFs】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
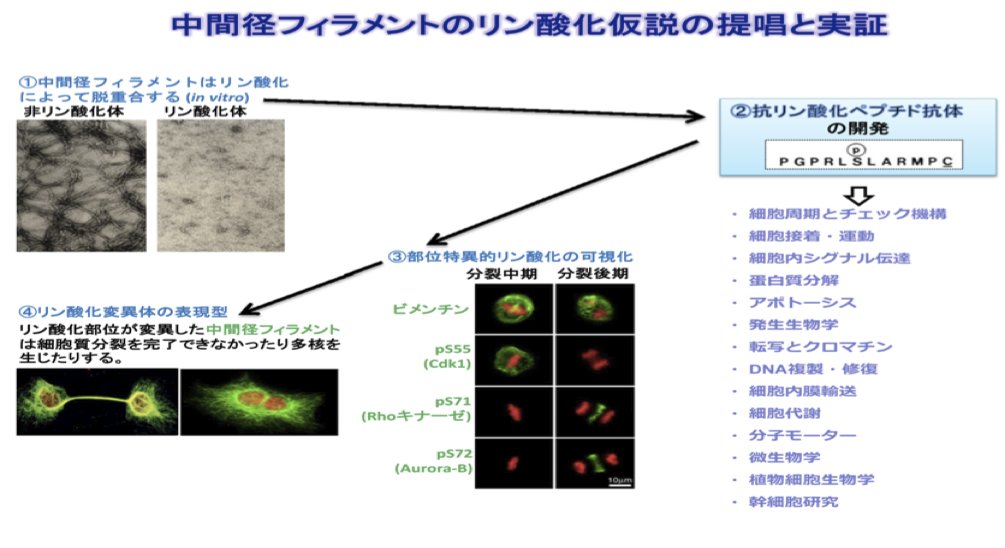
| 中間径フィラメント(中間径繊維と同義)はリン酸化により脱重合する。つまり、アクチン繊維や微小管と違い、基本的に濃度に依らない構築制御を受ける。そもそも中間径フィラメントは、非常に安定な不溶性の静的構造物と見なされていたため(中間径フィラメントの項を参照)、構築制御機構についての分子レベルでの理解は遅れていた。しかし1987年、稲垣昌樹博士ら(リンク1, 2)の報告により、中間径フィラメントの繊維構造がキナーゼによるリン酸化を受けて脱重合することがin vitroのビメンチン(vimentin)を用いた実験により明らかになった(fig1(1), 文献1)。この発見は、中間径フィラメントを動的な構造物として捉えなおす転機となり、従来の概念を変えたとされる。
この脱重合は細胞内現象として確認される必要があったため、アミノ酸残基のリン酸化を部位特異的に認識する抗体すなわち「抗リン酸化ペプチド抗体 (site- and phosphorylation state-specific antibody)」が同グループにより開発され、その作成から応用までが方法論として確立された(fig1(2), プロトコール1-3)。これらを用いた免疫染色により、ビメンチンが細胞分裂時に受ける複数の部位特異的リン酸化が可視化され、またそれぞれに特異的なキナーゼ(Cdk1, Rho-kinase, Aurora-B)が同定された(fig1(3); 総説1, 2)。さらにこのリン酸化部位を欠陥変異で置き換えると細胞質分裂が完了できなくなることを確認し(fig1(4))、このリン酸化による構築制御仮説は細胞現象、特に細胞分裂との関わりで実証された。 今、この方法論は細胞周期制御における重要なキナーゼカスケードの同定にも貢献している(fig1(2), 総説3)。 今後、このようなリン酸化変異体の影響を個体レベルで検討することが期待され、その研究は新展開を見せつつある。 参考文献リンク1) 愛知県がんセンター研究所・発がん制御研究部(稲垣昌樹研究室)
リンク2) 名古屋大学グローバルCOEプログラム 文献1) Inagaki M, Nishi Y, Nishizawa K, Matsuyama M, Sato C. Nature. 1987 Aug 13-19;328(6131):649-52. 総説1) Izawa I, Inagaki M. Cancer Sci. 2006 Mar;97(3):167-74. 総説2) 猪子誠人・後藤英仁, 中間径フィラメントの構築制御機構と細胞内機能, 細胞骨格と接着・蛋白質核酸酵素・2006年5月号増刊 (貝淵弘三・稲垣昌樹・佐邊壽孝・松崎文雄 編), 51, 551-558, 2006 総説3) 後藤英仁・稲垣昌樹, G2/M移行期におけるCDK1の活性化およびチェックポイント解除機構, 細胞周期フロンティア (佐方功幸・稲垣昌樹・岸本健雄 編),52-57, 共立出版, 2010 プロトコール1) Goto H, Inagaki M. Nat Protoc. 2007;2(10):2574-81. プロトコール2) 大海忍・辻村邦夫・稲垣昌樹 著, 抗ペプチド抗体実験プロトコール 新版, 秀潤社, 2004 プロトコール3) 後藤英仁・稲垣昌樹, Close Up実験法, 実験医学, 26, 2965-2972, 2008 |
| 培養基質の制御と細胞 |
|---|
| 【Regulation of culture substrate and cellular function】 |
| 原田 伊知郎 |
| 東京工業大学大学院生命理工学研究科 |
| 臓器・組織から取り出した細胞は培養液中で浮遊もしくはプラスチックシャーレの底に接着させて培養するのが一般的である。接着培養する細胞は、シャーレの底に物理吸着した細胞外マトリクス(以下ECM: Extracellular matrix) にインテグリン(Integrin)という膜タンパク質を介して接着している。したがって、細胞とECMとの接着の分子機構自体は生理的なものである。しかし、細胞外マトリクスが吸着しているプラスチックシャーレが生理条件下ではあり得ないほどの固いため、その環境は生体内とは著しく異なっていると考えられている。このような接着している細胞の足場(scaffold)の固さが細胞の機能に直接影響を及ぼしているのではないかという配慮から、近年様々な柔らかい培養基質が考案されている。 培養基質の固さの制御方法として細胞生物学的基礎研究によく用いられているのは電気泳動に用いるアクリルアミドゲルを培養基質とする方法である。アクリルアミドゲルは作成する際に添加する架橋剤の濃度を調整するだけで、容易に様々な固さのものを作成することができる。しかし、このゲルはタンパク質がほとんど吸着しないため、細胞外マトリクスもほとんど吸着しない。そのため、方法は様々であるがアクリルアミドゲルとECMとを架橋剤を介して結合させるのが一般的である。この培養基質を用いた研究によって、通常シャーレに培養した細胞に見られる極端な細胞骨格の発達や、アメーバのように広がった細胞の形はシャーレの固さが原因であったことが示されつつある。また、培養基質の固さを調整することで、細胞の分化能や増殖能などの機能も制御できることが示されている。 他にも様々な培養基質が考案されているものの、入手しやすいアクリルアミドゲルが多く用いられているもう一つの理由として、ゲルの透明度が上げられる。そのため細胞が観察しやすく広く普及している。特に、このゲル中に直径0.2〜1μmのマイクロビーズを包埋しておくと、ビーズの動きからゲルの歪みを計測することが出来るため、細胞が足場に力をかけている様子までも観察できる。そのため、細胞は移動に伴いどのような力を足場にかけているのか、等のような基礎研究にも本培養基質が用いられており、現在はTraction Force Microscopyとよばれ、新しい解析手法として普及している。 細胞が足場に加える力の制御・計測する他の方法として、ECMのマイクロパターニングやマイクロピラーを用いた研究も報告されている。カバーガラスにECMをプリントし、その形に細胞の形態を制御することで細胞骨格の発達を抑制し、柔らかい足場と同等の効果をねらった研究が報告されている。また、アクリルアミドゲルを用いたTraction Force Microscopyでは、接着点に直接かかっている力の定量化は逆問題であることから厳密な解析は難しい。そこで、3次元的なマイクロパターニング技術により、マイクロピラーをシリコンゴム(PDMS: polydimethylsiloxane)で作成して培養基板とすることで、一つ一つの接着点にかかる力のイメージングも試みられている。 参考文献(1) Pelham, R.J., and Y.L. Wang. 1997. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci USA. 94:13661-13665.
(2) Munevar, S., Y. Wang , and M. Dembo. 2001. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80:1744-1757. (3) Engler, A.J., S. Sen, H.L. Sweeney, and D.E. Discher. 2006. Matrix elasticity directs stem cell lineage specification. Cell. 126:677-689. (4)Tan, J.L., J. Tien, D.M. Pirone, D.S. Gray, K. Bhadriraju, and C.S. Chen. 2003. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proc Natl Acad Sci USA. 100:1484-1489. |
| 非筋ミオシンIIのリン酸化による制御 |
|---|
| 【Regulation of non-muscle myosin II function by its phosphorylation】 |
| 米村 重信 |
| 理化学研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
非筋細胞におけるミオシンIIはそのリン酸化によってATPase活性や会合能が制御されている。これは細胞の局所において、必要な時間だけミオシンIIが機能するためだと考えられている。常にアクチン繊維との相互作用によって収縮運動を行う骨格筋におけるミオシンIIではリン酸化による活性や会合能の制御が失われている。主要な調節を担うリン酸化を受けるのは生物種によって重鎖である場合と調節軽鎖(myosin regulatory light chain: MRLC)である場合があるが、ここではショウジョウバエから哺乳類まで広く見られるMRLCのリン酸化について述べる。哺乳類の場合、MRLCの19番目のセリン、18番目のスレオニンが順次リン酸化を受け、リン酸化を多く受ける程ATPase活性も会合したミオシンIIフィラメントも安定性も上昇することが生化学的にわかっている。ショウジョウバエではMRLCの変異体ではミオシンII活性に依存する細胞質分裂が異常になり、その異常はリン酸化されない変異MRLCでは回復せず、野生型あるいは疑似リン酸化型のMRLCの導入によって回復した。これらのことによりミオシンIIのリン酸化による制御の重要性がわかる。19番目のセリンのみがリン酸化されているMRLC (1P-MRLC)を認識する抗体、18番目のスレオニンと19番目のセリンと両方がリン酸化されているMRLC (2P-MRLC)を認識する抗体がそれぞれ作られている。野生型MRLC、リン酸化されない変異MRLC、擬似リン酸化型変異MRLCなどを細胞に発現させ、ミオシンIIのダイナミクスを観察すると、1P-MRLCは会合したミオシンIIと同じ局在を示すが、収縮しつつある場所には2P-MRLCが多いこと、ミオシンIIの細胞内の局所的な集積離散にはリン酸化脱リン酸化を繰り返すことのできるMRLCが重要であることがわかる。細胞内でリン酸化を行っているキナーゼにはミオシン軽鎖キナーゼ(MLCK)、ROCK/Rho-kinase、citron kinase、MRCK、ZIP kinaseなどが報告されており、阻害剤やノックダウン、ノックアウトの実験からその重要性が指摘されている。脱リン酸化の方はMYPT1というサブユニットを含むミオシンフォスファターゼが担当している。ROCK/Rho-kinaseは直接MRLCをリン酸化する能力があるとともに、MYPT1をリン酸化することによりミオシンフォスファターゼ活性を抑制し、細胞内のミオシンリン酸化に大きな役割を果たしていることがわかっている。参考文献 |
【S】
| s-FDAP法 |
|---|
| 【s-FDAP (sequential FDAP) analysis】 |
| 木内 泰 |
| 東北大学大学院生命科学研究科 分子生命科学専攻 単分子動態生物学分野 |
| お問合せ |
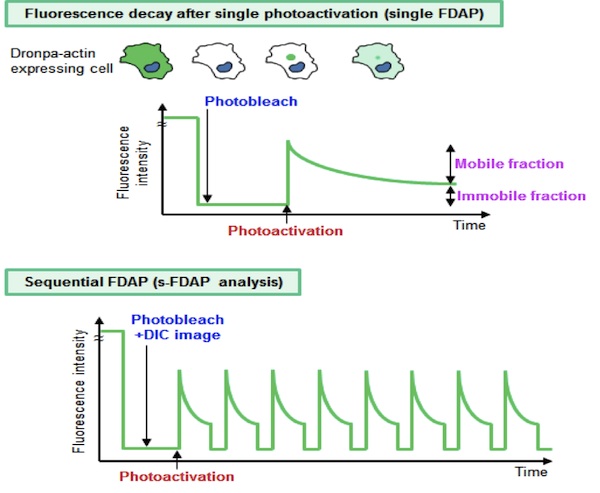
Dronpaは、AndoらによってクローニングされたGFP類似の単量体蛍光タンパク質である(1)。蛍光特性として、488nmの強いレーザー光で蛍光が消え(消光)、405nm又は458nmのレーザー光でその蛍光が回復し(光活性化)、光によって蛍光のスイッチのオン・オフを可逆的に繰り返すことができる。Dronpaをタグに付けたアクチンを細胞に発現させ、細胞全体で消光した後に一部で光活性化し、その後の蛍光強度の減衰を測定すれば、その減衰量は細胞質でのG-アクチン量を反映している(single FDAP)。そしてこの消光、光活性化、蛍光減衰の測定及び微分干渉像取得を繰り返すことで、細胞質のG-アクチン濃度の経時変化と細胞の形態変化を同一の細胞でモニターすることができる(s-FDAP analysis)(2)。
参考文献(1) Science, 306: 1370-1373, 2004. (2) J. Cell Biol., 193: 365-380, 2011. |
| 1分子イメージング法 |
|---|
| 【Single-molecule imaging technique】 |
| 原田 慶恵 |
| 京都大学 物質-細胞統合システム拠点(iCeMS) |
| お問合せ |
| 生体分子に様々な標識を付けて、それを手がかりに光学顕微鏡で個々の分子の局在や運動等を観察する手法を1分子イメージングあるいは1分子観察という。標識は大きく分けて2種類ある。大きな標識と、蛍光を発する標識である(蛍光1分子イメージング法の項を参照)。大きな標識を使う場合、1分子イメージングに特別な装置は不要で、光学顕微鏡で容易に観察できるという利点がある一方で、生体分子1個の観察ができているか、機能が損なわれていないかについての注意が必要である。大きな標識として直径1μm程度のマイクロビーズがよく使われる。マイクロビーズは光ピンセット(1分子操作法の項参照)で操作することや位置を精密に計測する実験(1分子操作法の項参照)にも使うことができ、1分子イメージングと1分子操作、1分子計測を組み合わせた実験を行うことができる。 |
| 1分子計測法 |
|---|
| 【Single-molecule measurement technique】 |
| 原田 慶恵 |
| 京都大学 物質-細胞統合システム拠点(iCeMS) |
| お問合せ |
| 生体分子に結合させた標識の位置や動きを高精度で1分子計測することで、個々の分子がどのようなメカニズムで機能しているのかを明らかにすることができる。
マイクロビーズなどの大きな標識は可視光で照明し、対物レンズでその像(影)を大きく(1000から10万倍)拡大し4分割のフォトダイオードに投影することで、その動きを1nm以下の精度で検出することができる。ただし、微小な動きを検出する場合は、標識のブラウン運動を防ぐために光ピンセット等で捕捉する必要がある。また、光ピンセットで捕捉することによって、そのバネ定数と検出した変位から、ビーズにかかっている力を見積もることができる。モータータンパク質であるキネシン分子を固定した直径1μmのビーズを光ピンセット(バネ定数~0.1pN/nm)で捕捉し微小管と相互作用させることで、キネシン分子が微小管に沿って8nmずつステップ状に動くことと最大7pNの力を出すことが明らかになった。また、RNAポリメラーゼがDNAの情報を1塩基ずつ読み進んでいく0.34nmステップの動きも同様の方法で検出された。 蛍光色素分子や量子ドットなどを1分子イメージング蛍光顕微鏡で観察した場合、直径が数百nmのぼやけた像として観察されるため、そのままでは、正確な位置はわからない。しかし、この像の光強度のプロファイルを解析することによってその中心点、すなわち蛍光物質の存在している位置をnm精度で決定することができる。この方法を使って二量体のモータータンパク質分子であるミオシンVが2つのモータードメインを交互に動かすことによってアクチンフィラメントに沿って運動することが明らかになった。 最近は量子ドットを使って、細胞内で1分子計測が行われ始めている。 |
| 1分子操作法 |
|---|
| 【Single-molecule manipulation technique】 |
| 原田 慶恵 |
| 京都大学 物質-細胞統合システム拠点(iCeMS) |
| お問合せ |
| 生体分子の機能を調べるためには個々の分子を操作する手法が有効である。1分子を捕捉、操作する方法としてレーザー光を対物レンズで集光させ、直径1~数μm程度の微小粒子を光でトラップする「光ピンセット」、プラスチックの中に酸化鉄が封入された磁気ビーズや磁性粒子を磁石を使って操作する「磁気ピンセット」、原子間力顕微鏡(AFM)の力測定モードなどが使われる。光ピンセットや磁気ピンセットの最大捕捉力は100pN程度、AFMは固いカンチレバーを使うことで、数百pN以上の大きな力で捕捉することができる。 2つの光ピンセットを使って、2個のビーズを捕捉し、その間に1本のDNA分子を伸展させ、RNAポリメラーゼ分子の結合を観察する実験や、DNAの片端をガラス基板上固定し、もう一方の端には磁気ビーズに結合させ、磁気ピンセットでDNAをねじった後、磁気ビーズの高さ変化を計測することで、トポイソメラーゼがATPを加水分解し、ねじれを解消する反応を検出した実験など、光ピンセットや磁気ピンセットはDNAを使った実験に使われることが多い。また、AFMを使い、カンチレバーの先端にタンパク質分子を結合させ、それを引っ張ってタンパク質分子のドメイン構造が壊れていく様子などが観察されている |
| スピニングディスク共焦点顕微鏡 |
|---|
| 【spinning-disk confocal microscope】 |
| 中野 明彦 |
| 東京大学大学院理学系研究科生物科学専攻 |
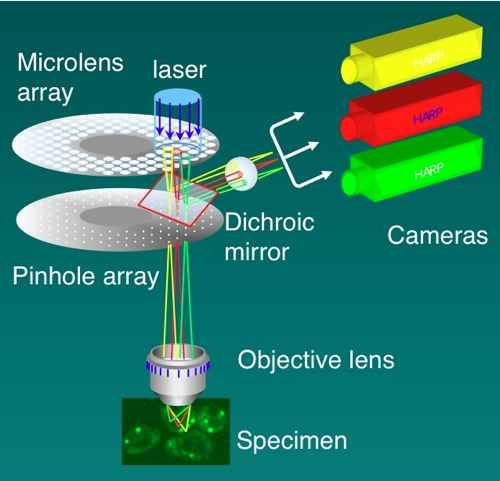
ニポウ板(Nipkow disk)式共焦点顕微鏡ともいう。小さな円盤に多数のピンホールを空け,高速で回転することによって試料を高速で走査する。横河電機が,ピンホールにレーザー光を効率よく導くためにマイクロレンズアレイを組み合わせて実用化した(図)。1000-2000フレーム/秒の高速性を誇る。同時に1000個程度の光点で試料を走査するため,ダメージが少ない,褪色しにくいなどの利点があり,また光学系は動かさないので実像を結び,高感度カメラで直接撮像できる。HARPカメラやEM-CCDカメラ,さらにイメージインテンシファイアなどとの組み合わせで,生細胞でも実際に1秒間に数百フレームの画像獲得が可能である。多色ダイクロイックミラー等を用いて複数種の蛍光プローブを完全同時観察でき,また高速性を生かしてオーバーサンプリングを行い,デコンボリューション処理することによって3Dで50-60 nmという超解像も実現されている。高性能なシステムは,SCLIM (Super-resolution Confocal Live Imaging Microscope)と呼ばれている。他の超解像顕微鏡に比べて,時間軸でも高い分解能を有することが特徴で,微細構造の高速な運動を追うライブセルイメージングの目的に適している。参考文献1. Nakano, A. (2002). Spinning-disk confocal microscopy -- a cutting-edge tool for imaging of membrane traffic. Cell Struct. Funct. 27:349-355. 2. Nakano, A. and Luini, A. (2010). Passage through the Golgi. Curr. Opin. Cell Biol. 22:471-478. 3. Matsuura-Tokita, K., Takeuchi, M., Ichihara, A., Mikuriya, K., and Nakano, A. (2006). Live imaging of yeast Golgi cisternal maturation. Nature 441:1007-1010. 4. Okamoto, M., Kurokawa, K., Matsuura-Tokita, K., Saito, C., Hirata, R., and Nakano, A. High-curvature domains of the endoplasmic reticulum (ER) are important for the organization of ER exit sites in Saccharomyces cerevisiae. J. Cell Sci. in press. |
| セプチン |
|---|
| 【Septin】 |
| 上谷 大介・木下 専 |
| 名古屋大学大学院理学研究科 生命理学専攻 情報機構学講座 |
| お問合せ |
セプチンは細胞質分裂(septation)・細胞極性・細胞形態の異常を呈する出芽酵母変異体の責任蛋白質として同定された重合性GTP結合蛋白質とそのホモログの総称である。セプチンファミリーはRas様のGTP/GDP結合領域をコアドメインとして共有し、多くはカルボキシル側にコイルドコイル配列を持つ。セプチン遺伝子は菌類からヒトまでの真核生物で進化的に保存され、出芽酵母では7種類、線虫では2種類、ショウジョウバエでは5種類、マウスでは13種類、ヒトでは14種類存在するが植物には存在しない。セプチンは多様な組み合わせでフィラメント状ヘテロオリゴマーを形成し、さらに環状線維束を形成したり人工リン脂質膜上で2次元格子を形成するなど独特の高次集合性を持つ。セプチンを主成分とする環状構造体としては出芽酵母の分裂溝直下に形成されるセプチン・リング(septin ring)がよく研究されてきた。セプチン・リングは細胞周期進行および細胞質分裂関連分子を集積させる足場(scaffold)としての役割と、細胞膜および内膜系上を流動する膜蛋白質の非対称性分布を保つ拡散障壁(diffusion barrier)として母-娘細胞を区画化する役割を持つことが報告されている。細胞質分裂の分子機構は種間・系譜間の多様性が著しく、セプチン・リングが明確に同定できない場合も多いが、セプチンの要求性は種を超えて保存されている。多細胞生物におけるセプチンの発現はむしろ分裂後の細胞に多いため、細胞質分裂以外の機能に興味が持たれている。哺乳類においては、精子鞭毛内(輪状小体)と繊毛基部の細胞膜直下にセプチンを主成分とすると推測される環状構造体が存在し、足場・拡散障壁機能以外に細胞表層剛性維持機能を持つことが示されている。哺乳類のセプチンの一部は非筋型ミオシンと相互作用することにより、アクトミオシンを主成分とする収縮輪やアクチンストレス線維(actin stress fiber)の維持に寄与するが、詳細は不明である。ヒトでは優性変異型SEPT9 が家族性神経痛性筋萎縮症の原因となるほか、パーキンソン病、統合失調症、精子無力症では複数のセプチンの量的・質的異常が随伴する。参考文献木下 専 蛋白質 核酸 酵素 54, 1150-1158 (2009)
Weirich CS, Erzberger JP, Barral Y. The septin family of GTPases: architecture and dynamics.Nat Rev Mol Cell Biol. 9(6):478-89, 2008. |
| 蛍光1分子イメージング法 |
|---|
| 【Single fluorescent molecule imaging technique】 |
| 原田 慶恵 |
| 京都大学 物質-細胞統合システム拠点(iCeMS) |
| お問合せ |
| 蛍光色素、蛍光タンパク質、量子ドットなどの蛍光物質を個々の生体分子に標識して蛍光顕微鏡と高感度カメラを使って個々の分子を観察する方法である。特に、蛍光色素や蛍光タンパク質の場合は、微弱な蛍光を検出しなければならない。そのため、背景光を激減させることができるエバネッセント照明を組み込んだエバネッセント蛍光顕微鏡を使う。レーザーと光学部品を使ってエバネッセント照明の光学系を自作することもできるが、対物レンズ型エバネッセント照明を組み込んだ顕微鏡システムも市販されている。 エバネッセント照明法ではガラス基板から100nm程度の深さまでしか観察できないので細胞表面の観察は可能であるが、細胞の中を観察する実験には用いることができない。そこで考案されたのが斜光照明法である。斜光照明法を用いることで、細胞内の蛍光色素分子も1分子イメージングが可能になる。さまざまな蛍光プローブのうち、量子ドットは非常に明るく、退色しないので、in vitroの実験だけでなく、細胞内や個体内で1分子を追跡する実験に用いられている。 |
| 酵母の中心体:スピンドル極体 |
|---|
| 【SPB: spindle pole body】 |
| 戸谷 美夏 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
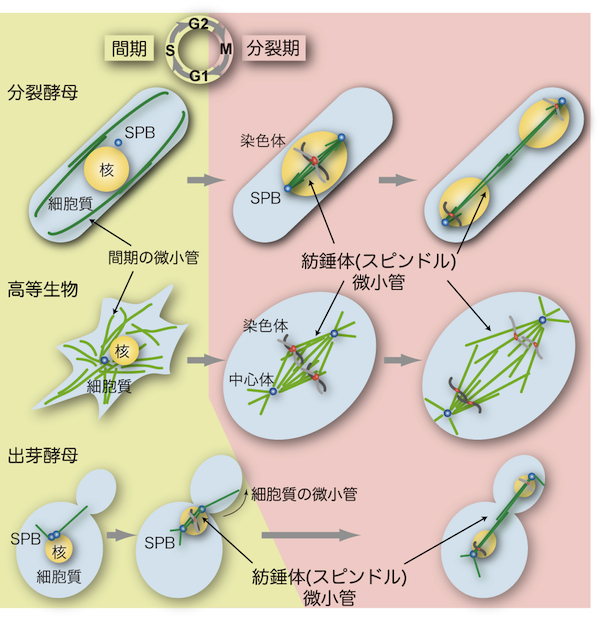
| 酵母は、動物細胞における中心体に相当する細胞内小器官として、スピンドル極体 (SPBと呼ばれることが多い)をもつ。SPBは、直径約100nm程度の円盤が重なったような、中心体とは大きく異なる構造をもつが、中心体と同様に、細胞内で微小管形成中心(MTOC: microtubule organizing center)として働いている(図参照)。SPBと中心体には、微小管の形成起点となるγチューブリン複合体 (γ-tubulin complex) が局在する。それ以外にも、SPBと中心体を構成する因子には、互いに機能的な相同性をもつタンパク質が多く含まれる。 細胞分裂時には、 SPBは、 スピンドル微小管(高等生物の紡錘体:「酵母の紡錘体微小管」の項を参照)の形成起点として両極に存在し、微小管のマイナス端を繋ぎ止めて、精確な染色体の分配に貢献している。細胞分裂により母娘細胞に分配されたSPBは、1細胞周期に1回だけの複製を行って、細胞内での数を保っている。 酵母では、細胞分裂期にも核膜が消失しないため、SPBは、核膜に埋め込まれて、核内にスピンドル微小管を形成する(「酵母の核分裂」の項を参照)。 出芽酵母のSPBは、 複製されたばかりの新しいSPBが一過的に核膜の外に観察されるが、すぐに核膜に埋め込まれ、 その後は細胞周期を通して核膜に埋め込まれて存在する。分裂酵母のSPBは、分裂期にのみ核膜に埋め込まれて核内にスピンドル微小管を形成する。間期には、核膜に添うように細胞質側に存在し、細胞質微小管のMTOCのひとつとして働いている。 減数分裂では、染色体組換えの時期に、核内の微小管がSPBによってひとつに束ねられる。分裂酵母では、SPBが先頭になって核を引っ張りまわすように動き、相同染色体の効率的な組換えを可能にしている(「酵母の微小管」の項を参照)。 SPBと中心体は、MTOCとしての働きのほかにも、情報伝達分子の足場としての役割をもつ。分裂期に重要な複数のキナーゼが、 SPB・中心体に局在することが知られている。分裂酵母では隔壁形成を制御する分子群(SIN: septation initiation network)、出芽酵母では分裂期脱出を制御する分子群 (MEN: mitosis exit network)なども、SPBに局在する。複製されたSPBが等価ではない(成熟度の違いによってOldとNewの区別が生じる)ことを利用した、非対称や極性の制御に関わるしくみの存在が示唆される。細胞分裂に非対称性を与えることも、SPB・中心体の重要な役割であると考えられる。 参考文献 |
| 酵母の紡錘体微小管 |
|---|
| 【Spindle microtubules in yeast】 |
| 佐藤 政充 |
| 東京大学大学院理学系研究科生物化学専攻 |
| お問合せ |
| 紡錘体(スピンドル、spindle)は微小管(microtubule)の束が多数集まって構成される細胞内の構造である。真核細胞において紡錘体はゲノム染色体を2個の娘細胞に分配するために必要不可欠の役割を担う(「紡錘体微小管」の項を参照)。酵母における紡錘体微小管の基本的な機能や性質は高等生物のものと良く似ているが、相違点もいくつかある。 高等生物では一般的に紡錘体はひし形であるが、酵母では微小管が束ねられて直線状の形を示す(図参照)。また、酵母では分裂期でも核膜が崩壊しない(closed mitosisと呼ばれる)ため、紡錘体が核内に形成されるという大きな特徴がある(「酵母の核分裂」の項を参照)。 分裂酵母では、間期(interphase)に見られる細胞質の微小管構造は分裂期(mitosis)になると消失し、かわりに核内に紡錘体微小管を形成する(図参照)[1]。このように、細胞周期の時期に応じて、微小管の形成される場所が細胞質から核へと移る。その分子メカニズムはまだ明らかにされていないが、第一に微小管を安定化するタンパク質が核内に蓄積することが重要であり、第二に微小管を形成する原点であるスピンドル極体(SPB;「酵母の中心体」の項を参照)が分裂期に核膜に埋め込まれることが必要であると考えられる[2, 3]。 これに対して、出芽酵母のSPBは細胞周期を通して常に核膜に埋め込まれているため(「酵母の中心体」の項を参照)、間期でも核内にわずかながら微小管構造が存在し[4]、分裂期に突入する前のG2期の段階で紡錘体を形成する(図参照)。さらに出芽酵母では、出芽した娘細胞に核を正しく分配させるために、細胞質の微小管が細胞の内壁をたどっていき紡錘体を回転させ(spindle orientation、図参照)、核を娘細胞へと誘導する。 紡錘体微小管は、複製された染色体の動原体部位(キネトコア、kinetochore)を接着して両極に引っ張ることで染色体を分配する。微小管の接着が未完了の場合や、不適切な接着が起きた場合には、紡錘体形成チェックポイント(spindle assembly checkpoint)と呼ばれる監視機構が活性化して、すべての動原体が微小管によって正しく捕捉されるまで細胞周期を分裂中期(metaphase)に停止させる。Mad2やBub1などのチェックポイント因子は酵母からヒトまで真核細胞生物で幅広く保存されている。 参考文献 |
| 静的残留と動的逆送 |
|---|
| 【static retention】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| AからBへという2つの細胞小器官の間でのタンパク質の輸送過程で,Bに進む積み荷タンパク質とAに留まるレジデントタンパク質の選別の概念。レジデントタンパク質が,Aから運び出されることなく留まるメカニズムが静的残留(static retention),Bに一旦輸送されてからAに送り戻されるのが動的逆送(dynamic retrieval)である。歴史的には,BiPなど小胞体に局在するタンパク質のシグナルとしてKDEL配列が同定され,当初小胞体残留シグナルと呼ばれたが,のちにゴルジ体から逆送されるためのシグナルであることが証明されて,より一般的な小胞体局在化シグナルという呼び方に落ち着いた。なお,retrievalは「回収,検索」といった意味の言葉であり,回収シグナルという表現も使われる。これを逆送と訳したのは,retrograde transport(逆行輸送)を意識した意訳である。 |
| 超解像顕微鏡法 |
|---|
| 【Super-resolution Microscopy】 |
| 岡田 康志 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| 光が波としての性質(回折)を示すために、無限に小さな光源であっても、その光学顕微鏡像は波長の半分程度の大きさに滲んでしまう。可視光の場合、その大きさは200~300nmであり、これにより光学顕微鏡の分解能は規定される(回折限界 diffraction limit)。
近年、蛍光分子の特性を上手く活用することで回折限界を超える高い分解能を達成する技術が複数開発され、超解像顕微鏡法(super-resolution microscopy)と総称されている。現在よく知られている超解像顕微鏡法には、大きく分けて3つの種類がある。 1. 蛍光分子局在顕微鏡法(fluorescence localization microscopy) PALM/STORM/GSDIM (Photo Activation and Localization Microscopy, STochastic Optical Reconstruction Microscopy, Ground State Depletion and Individual Molecule return)と様々な名前が付けられているが、その基本的な原理は共通で、視野内の蛍光分子をランダムに個別に点滅させることで超解像を達成する。同時に点灯している蛍光分子の間隔が十分広ければ、各蛍光分子の位置の決定精度は画像のS/Nによって定まるので、回折限界以上の精度を達成することが出来る。これを多数回繰り返すことで視野内の蛍光分子すべての位置を決定し、その位置情報から画像を構築することで、超解像蛍光像が再構成される。そのため、分解能は、蛍光分子の位置決定精度で定まり、30 nm 以上の分解能が達成できる (fig1 画像1=通常蛍光像、画像2=PALM像 試料:微小管)。 この方法の発展型として、蛍光分子の明滅や消退による蛍光強度の揺らぎが蛍光分子を単位とする確率的な現象であることを利用して、蛍光強度の変動から超解像蛍光像を再構成する手法も開発されている(SOFI: Super-resolution Optical Fluctuation Imaging) 2. 構造化照明法(SIM: Structured Illumination Microscopy) SIMは、モアレ干渉を利用して特定方向の高分解能成分を取得する方法である。3方向×5位相の合計15枚の画像から再構成することで、x,y,zすべての方向で通常の蛍光顕微鏡の約2倍の分解能が達成できる。従って、例えばGFPなどの場合120 nm程度の分解能が期待できる。これは他の超解像手法顕微鏡法に比べると低い分解能であるが、蛍光色素の制約がないので、容易に多重標識の3次元超解像像を得られるのが特徴である。画像3(fig2)は、SIMによるミトコンドリア像。ミトコンドリアの内部構造を見ることが出来る。 3. 誘導放出制御法(STED: Stimulated Emission Depletion) STEDは、レーザー走査型コンフォーカル顕微鏡(CLSM: Confocal Laser Scanning Microscopy)の発展型である。誘導放出を利用してレーザーで蛍光が励起される点の大きさを回折限界以下に絞り込むことで超解像を達成する。従って、通常のCLSMと同様の操作で高速超解像イメージングが出来る。分解能は誘導放出制御光強度の平方根で決まり、およそ約50~80nmである (fig3 画像4:通常CLSM像、画像5:STED像 試料:EYFP標識F-actin)。ただし、使用できる色素には、励起光、蛍光、誘導放出光の3つがそれぞれ異なる波長の条件を満たす必要があるため、多重染色は困難である。 参考文献 |
| 紡錘体形成 |
|---|
| 【Spindle assembly】 |
| 五島 剛太 |
| 名古屋大学大学院理学研究科生命理学専攻 |
| お問合せ |
紡錘体(スピンドル:spindle)は細胞分裂の際に形成される双極性(bipolar)の構造体であり、細胞分裂装置(mitotic apparatus)と呼ぶこともある。染色体を娘細胞へと分配し、細胞質分裂を制御するために必須の役割を果たす。主要構成因子はチューブリン(tubulin)の重合体である微小管(microtubule)、および、さまざまな微小管結合蛋白質(microtubule-associated protein: MAP)である。動物体細胞においては2つの中心体(centrosome)が主な微小管形成中心(microtubule organising centre: MTOC)となり、中心体から伸びた微小管が凝縮した染色体を捕捉する。一方、植物細胞や減数分裂期の動物細胞の一部には中心体が存在せず、別のメカニズムにより紡錘体微小管が生み出されている。これまでに、染色体自身が微小管の形成を誘導することや(Ran GTPアーゼやAurora Bキナーゼが関わる)、既存の微小管に依存して新たに微小管が生み出される微小管増幅経路(オーグミン複合体が関与する)の存在が明らかにされた。また、動物体細胞においてもこうした経路が中心体経路と同時に働いていることも明らかになった。参考文献 |
【T】
| TRIOBP |
|---|
| 【TRIOBP】 |
| 北尻 真一郎 |
| 京都大学医学部附属病院耳鼻咽喉科 |
| お問合せ |
| T管 |
|---|
| 【T-tubule】 |
| 藤田 尚信 |
| 東北大学生命科学研究科 |
筋細胞内に張り巡らされた管状の膜構造体。横行小管とも呼ばれる。筋細胞膜が貫入した構造であり、筋細胞表面積の80%以上を占める。T管は、筋細胞内の至る所で筋小胞体と接触部位を形成し、筋小胞体からのカルシウムイオンの放出を制御する。1956年にGorge Palade博士らにより初めて報告された[1]。興奮収縮関連において、運動神経から筋細胞へ伝えられた活動電位は、T管を伝わり、筋小胞体からカルシウムイオンを放出させ、筋細胞の収縮を引き起こす。T管は効率的かつ同調した筋細胞の収縮に必要であり、その異常は骨格筋や心筋の不全につながることが知られている[2]。参考文献1. Porter, K.R., and Palade, G.E. (1957). Studies on the endoplasmic reticulum. III. Its form and distribution in striated muscle cells. J Biophys Biochem Cytol 3, 269-300. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2224093/
2. Al-Qusairi, L., and Laporte, J. (2011). T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet Muscle 1, 26. |
| タリン |
|---|
| 【talin】 |
| 辻岡 政経 |
| 大阪大学大学院理学研究科 |
| お問合せ |
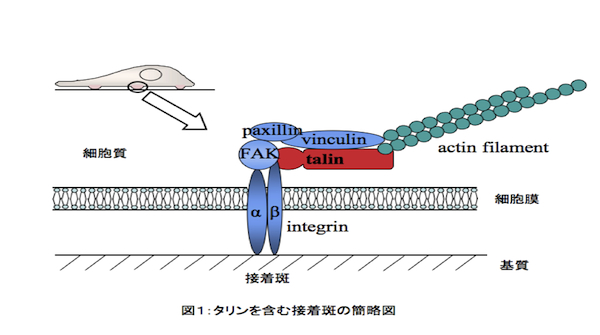
接着斑と呼ばれる細胞接着構造を構成する分子の一つ。およそ270kDaの大型のタンパク質で、FERMドメインと呼ばれる50kDa程度の球状領域と220kDa程度のロッド状領域からなる。脊椎動物は二つのタリン(talin)遺伝子を持ち、このうちの一方(talin1)について重点的に研究されてきた。接着斑では、接着分子であるインテグリン(integrin)が細胞外基質と結合し、その細胞質側でタリンをはじめ、多様なタンパク質と複合体を形成している(図1)。タリンはα鎖とβ鎖からなるインテグリンのβ鎖に結合して構造変化を引き起こし、接着可能な状態にすると同時にアクチンフィラメントにも結合して両者を繋ぐ。加えてアクチン結合タンパク質ビンキュリン(vinculin)やFAKキナーゼなどのタンパク質とも結合して複合体の核となり、接着斑の成熟、接着斑を介した細胞内外のシグナル伝達、力伝達に重要な役割を果たす。実際、talin1の機能を阻害した細胞は接着に異常を生じる。また、talin1欠損マウスは胚性致死である。近年ではもう一方のタリン(talin2)の解析も着手されており、両者の機能重複が報告される一方、性質の違いや異なる接着斑への局在など、特有の機能も示唆されている。タリンはホヤやショウジョウバエ、線虫、細胞性粘菌などにも広く存在する。なかでも粘菌は、二つのタリンの同時欠損株が単離されている唯一の生物であり、この変異細胞は基質に全く接着できない。さらに、この二つのタリンは粘菌の発生の異なる時期に働いており、タリンの機能の重複と特異性が示唆された最初の例である。参考文献 |
| トロポモジュリン |
|---|
| 【tropomodulin】 |
| 山城 佐和子・渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
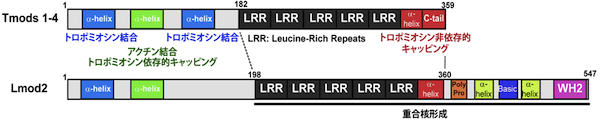
アクチン線維マイナス端 (矢じり端 または pointed end) キャッピングタンパク質。マイナス端に弱く結合する(解離定数= 約 0.1 μM)が、 アクチン結合タンパク質トロポミオシンにも結合し、トロポミオシンが結合したアクチン線維に対して強いキャッピング活性を示す(解離定数=約 0.2 nM)。海綿以後の多細胞生物で普遍的に存在し、酵母と植物では相同遺伝子は同定されていない。ほとんどの脊椎動物は4つの分子種(Tmod1-4) を持つ。生体内では、マイナス端キャッピング活性によりアクチン線維の安定性と長さを調節すると推測されており、心筋・骨格筋の筋原繊維形成、及び、赤血球・上皮細胞・レンズ繊維細胞のスペクトリン細胞膜骨格の形成と維持に関与する。ショウジョウバエ飛翔筋の筋原繊維と赤血球のスペクトリン細胞膜骨格では、アクチン繊維の長さ調節に関与する。培養細胞の細胞運動では、Tmod3 がラメリポディアに局在し、アクチン線維のダイナミックな再編成の調節に関与する。脊椎動物では、類縁のアクチン結合タンパク質にライオモディン (leiomodin, Lmod1-3) があり、N末端側のトロポモジュリン相同ドメインと、C末端側の アクチン結合WH2モチーフを含むドメインからなる (画像参照)。ライオモディンは強いアクチン重合核形成活性を持ち、この活性にはトロポモジュリン相同ドメインの一部 (leucine-rich repeats) とC末端側のドメインが必要である。横紋筋及び平滑筋に発現し、Lmod2 は筋原繊維形成に関与する。 参考文献Yamashiro S, Gokhin DS, Kimura S, Nowak RB and Fowler VM, Tropomodulins: pointed-end capping proteins that regulate actin filament architecture in diverse cell types. Cytoskeleton in press
Gokhin DS and Fowler VM, Tropomodulin capping of actin filaments in striate muscle development and physiology. J Biomed Biotechnol. 2011 Epub 2011 Oct 17. |
| 二光子励起顕微鏡法(多光子励起顕微鏡法) |
|---|
| 【Two-photon excitation microscopy, multi-photon excitation microscopy】 |
| 松田 道行 |
| 京都大学大学院生命科学研究科 生体制御学分野 |
| お問合せ |
二光子励起顕微鏡法とは、二光子吸収過程により分子を励起し、その蛍光を観察する顕微鏡法である。三光子励起も報告されているので多光子顕微鏡という用語を使う場合も多い。一分子が同時に二つの光子により励起される確率は自然界ではゼロといってよく、フェムト秒超短パルス高出力レーザが開発されて初めてこの現象が観察されるようになった。光密度が二光子励起を誘導するまでに高くできるのはレンズの焦点のみであるため、光路上の焦点以外に存在する分子は励起されない。これにより、二光子顕微鏡法では背景光がほぼなくなり、高いシグナルノイズ比が達成される。また、赤外レーザを使うため、組織透過性が高い。動作距離の長いレンズや、散乱を減少させる方法の開発により、脳組織では数mm程度の深部まで蛍光観察できるようになっている。近年、生きた生物で様々な細胞の動きや機能をリアルタイムに観察するintravital imagingという分野が発展しているが、その牽引力となっている技術である(1)。参考文献 |

 HOME
HOME