- ホーム
- >
- 細胞生物学用語集トップ
- >
- 細胞生物学用語集【さ行】
細胞生物学用語集【さ行】
【さ】
| cAMPによるアクチン細胞骨格制御 |
|---|
| 【cAMP-regulated actin cytoskeleton】 |
| 福原 茂朋・望月 直樹 |
| 国立循環器病研究センター研究所 細胞生物学部 |
| お問合せ |
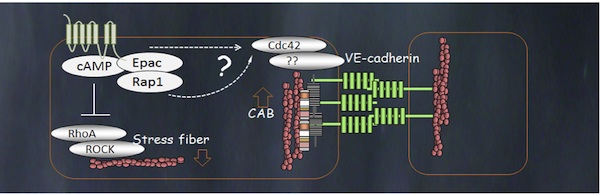
cAMPがA-キナーゼではなく、Epac (低分子量GTP結合蛋白質Rap1のグアニンヌクレオチド交換因子)の活性化によりGTP-Rap1を増加させる。さらにCdc42の活性化が生じるとともに、血管内皮細胞では、β/α-カテニンを介したVascular endothelial cadherin (VE-cadherin)とcortical actin cable (CAB)の結合が促進される。また一方、Rhoの抑制によるventral stress fiberの抑制も見られる。結果としてVE-cadherinの細胞間接着の安定化により、相対的に細胞-細胞間接着が増強され、細胞―基質間接着が減弱されることになる (図参照)。Rap1がどのようなシグナルでCdc42を活性化するのか?, Cdc42がいかにしてCABの形成を促進するのか?は不明である。Epacが発現する細胞種によってEpacの下流因子が変わるために(心臓ではRap1-PLCepsilon, 膵臓ではKチャンネルなど)アクチンの制御に関わるのがはっきりしているのはRap1-Cdc42系のシグナルが明らかな血管内皮細胞だけである。血管内皮細胞ではアドレノメデュリン受容体やアドレナリン受容体などのGs-アデニル酸シクラーゼ系を活性化するG蛋白質共役型受容体が発現するためにcAMP-Epacによるアクチン骨格制御系が機能する。A-キナーゼによるアクチン細胞骨格の直接制御についても上皮細胞・内皮細胞ともに明確な調節機構は明らかにされていない。参考文献1. Noda K, Zhang J, Fukuhara S, Kunimoto S, Yoshimura M, Mochizuki N. Vascular Endothelial-Cadherin Stabilizes at Cell-Cell Junctions by Anchoring to Circumferential Actin Bundles through a- and b-Catenins in Cyclic AMP-Epac-Rap1 Signal-activated Endothelial Cells. Mol Biol Cell. 21:584-96, 2010
2. Fukuhara S, Sakurai A, Sano H, Yamagishi A, Somekawa S, Takakura N, Saito Y, Kangawa K, Mochizuki N. Cyclic AMP potentiates VE-cadherin-mediated cell-cell contact to enhance endothelial barrier function through Epac-Rap1 siganaling pathway. Mol. Cell Biol. 25: 136-146, 2005 |
| サイトカラシンD |
|---|
| 【Cytochalasin D】 |
| 大橋 一正 |
| 東北大学大学院生命科学研究科 |
| 真菌の毒素から単離された低分子化合物でアクチンの重合阻害剤。細胞膜透過性である。サイトカラシンB等の誘導体が複数存在する。
サイトカラシンDの作用は、アクチン繊維のプラス端に高い親和性で結合し(kd値:2 nM)、新たな重合を阻害するものである。また、弱く単量体や2量体のアクチンに結合する(kd値:2.6-17μM, Mg2+存在下)。繊維芽細胞に対して作用させた場合は、細胞内F-アクチンの脱重合を促進しないことが報告されている。これに対し、活性化した血小板に作用させた場合には、血小板内のF-アクチンが脱重合することが報告されている。これまでの報告を総合すると、定常状態の細胞に対してサイトカラシンDを作用させた場合、細胞内のF-アクチンの脱重合は促進されないと考えられる。細胞内ではアクチン線維が重合と脱重合の平衡状態にあるため、サイトカラシンDのアクチンのプラス端キャッピング活性だけではこの現象を説明できない。アクチンのプラス端キャッピング活性の他に何らかのアクチン線維の脱重合を抑制する作用があると考えられる。 参考文献 |
| 細胞質とサイトゾル |
|---|
| 【cytoplasm】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| これも前項と同様,歴史と共に意味合いが変遷してきている。細胞質(cytoplasm)は,細胞のうち細胞核を除いた部分,というのがもともとの定義である。したがって,本来の意味では,核以外の細胞小器官は全て含まれることになる。しかし,これも電子顕微鏡以前の定義であり,複雑な細胞内の微細構造が理解されるようになった今,核以外を全て一緒くたにして考えるというのは,あまり効率のよい話ではない。細胞質から細胞小器官や細胞骨格などの大型の構造を除いた,可溶性の部分のことを細胞質基質(cytosol)と呼ぶが,これも,リボソームやプロテオソームなどの巨大な分子複合体が含まれるのかどうかというと,結構微妙なことになってくる。ミクロソームが,超遠心ではじめて沈殿する膜分画と定義されたように,それでも沈殿しない画分をサイトゾルと定義してしまえば,ある意味すっきりするのかもしれない。現在では,cytoplasmicとcytosolicという2つの言葉はしばしば同様の意味に用いられている。本来の定義からするとけしからぬことかもしれないが,混乱のない限りやむを得ない流れなのかもしれない。一方で,細胞小器官を含む細胞質という概念も,細胞質遺伝(ミトコンドリアゲノムおよび葉緑体ゲノムが支配する遺伝様式のこと)という言葉でしっかり残っているので,場合によっては十分な注意が必要である。 |
| 細胞質スプライシング |
|---|
| 【Cytoplasmic mRNA splicing】 |
| 吉田 秀郎 |
| 兵庫県立大学大学院生命理学研究科生体物質化学II講座 |
細胞質スプライシングは、従来知られているmRNAスプライシングとは全く異なる新規のmRNAスプライシング機構である。従来型のスプライシングは核で起こり、スプライソソームが反応を触媒する。イントロンとエクソンの境界にはコンセンサス配列(GU-AGまたはAU-AC配列)が存在し、まず5’側が切断されてラリアット構造を形成した後、3'側が切断される。しかしながら、細胞質スプライシングはスプライソソームには依存せず、小胞体ストレスセンサーであるIRE1によって切断され、未知のRNA ligaseによって結合される。エクソンとイントロンの境界にGU-AGまたはAU-AC配列は存在せず、その代わり特徴的なステム−ループ構造が存在している。細胞質スプライシングはIRE1が存在する小胞体膜上で起こり、核内では起こらないと考えられている。現在のところ、細胞質スプライシングの基質mRNAは動物のXBP1と酵母のHAC1だけである(いずれも小胞体ストレス応答を制御する転写因子)。参考文献Cell (2001) 107, 103-114
Cell (2001) 107, 881-891 |
| 細胞性粘菌におけるアクチン細胞骨格 |
|---|
| 【Actin-cytoskeleton in Dictyostelium cells】 |
| 祐村 恵彦 |
| 山口大学大学院医学系研究科 |
土壌生物である細胞性粘菌は,その生活環に単細胞と多細胞の時期を持つ。単細胞は走化性運動により集合することで多細胞になる。この細胞の運動は白血球に酷似しており,白血球や動物細胞の細胞運動のモデル生物として研究されている。細胞の運動機構は,細胞前端部でのアクチン繊維重合による細胞膜の押し出しと,細胞尾部に局在するミオシンII(骨格筋のミオシンに似る)によるATP依存的な尾部収縮によると考えられている。細胞性粘菌の細胞のアクチン繊維の細胞内分布を蛍光ファロイジン染色で調べると,仮足に最も多くのアクチンが存在しており,ストレスファイバーのような大きな束構造はない。これ以外にも,細胞膜を裏打ちする構造,点状の基質接着部位,尾部ではミオシンIIと相互作用できるようなアクチン繊維束が存在する。細胞質には多量の単量体のプールが存在し,細胞前端部でのアクチン繊維はArp2/3複合体により,Y字に枝分かれした状態で膜の方から重合が進行する。重合には多くのアクチン結合タンパク質が関与する。細胞分裂の最終段階である細胞質分裂時には,分裂面にアクチンとミオシンIIからなる収縮環が形成され,この構造の収縮により,細胞は2つの嬢細胞に分断される。ミオシンII欠損細胞では,収縮環依存の細胞質分裂ができないため,多核化する。参考文献Yumura, S. and T. Q. P. Uyeda. (2003).
Myosins and cell dynamics in cellular slime molds. International Review of Cytology, 224:173-226. PubMed |
| 細胞内アクチン濃度 |
|---|
| 【The intracellular actin concentration】 |
| 木内 泰 |
| 東北大学大学院生命科学研究科 |
ほとんどの真核細胞でアクチンは最も大量に存在するタンパク質で、その濃度は数百μMに達する。単量体アクチン(G-アクチン)とアクチン線維(F-アクチン)はおよそ1対1の比率で存在する。G-アクチンが重合しないで存在できる臨界濃度は0.1μMと低く、細胞質のG-アクチンはサイモシンβ4ファミリーを中心とする隔離タンパク質が結合することで重合が抑制されている。G-アクチンは、ADF/コフィリンによるF-アクチンの切断・脱重合によって細胞質にADP-G-アクチンとして放出され、プロフィリンによってADPがATPに交換されATP-G-アクチンとなり、再び重合に使われる。細胞質で他のタンパク質と結合していないG-アクチンやプロフィリンと結合しているG-アクチンは重合可能で、それらの濃度は細胞内でのアクチン重合速度を決定する重要な因子である。細胞質G-アクチンの大半は重合できないサイモシンβ4結合型G-アクチンであり、G-アクチンとサイモシンβ4が結合・解離を繰り返す平衡状態にある。細胞が外的刺激を受けアクチン重合が促進された場合、この平衡は解離側に動いて、大量に存在するサイモシンβ4結合型G-アクチンプールからG-アクチンが供給され、アクチン重合に使われる。このように細胞は、G-アクチンを高い濃度に保つことで刺激に応じた素早いアクチン重合を引き起こすことができる。最近開発されたs-FDAP法によって、細胞内でのG-アクチン濃度の経時的、空間的な変化が詳細に測定できるようになった。参考文献Pollard, T.D., Blanchoin, L., Mullins, R.D. (2000) Annu. Rev. Biophys. Biomol. Struct. 29: 545-576.
Carlier, M.-F., Pantaloni, D. (2007) J. Biol. Chem. 282: 23005-23009. Watanabe, N. (2010) Proc. Jpn. Acad., Ser. B 86: 62-83. Kiuchi, T., Nagai, T., Ohashi, K., Mizuno, K. (2011) J. Cell Biol. 193: 365-380. |
| 細胞分裂軸 |
|---|
| 【Cell division axis】 |
| 豊島 文子 |
| 京都大学ウイルス研究所 細胞生物学研究部門 構造形成学研究分野 |
| 細胞が分裂する方向のことであり、細胞分裂面と垂直に交わる軸方向を指す。細胞分裂軸は分裂期紡錘体の両極を結ぶ線と平行であるため、紡錘体軸の方向によって分裂軸が決定される。紡錘体軸は多くの場合、分裂中期に決定されるが、幾つかの組織・細胞では分裂後期に軸方向が変化するとの報告もある。
紡錘体軸の方向は「細胞の形」「細胞極性」「細胞―細胞間接着」「細胞ー細胞外基質接着」などの細胞内外の要因によって決定される。細胞は、周囲の環境や細胞の分化過程によって、これらの要因を使い分けている。そのため、紡錘体軸を決める分子機構は細胞や組織の種類によって異なる。進化的に保存されている紡錘体軸制御因子としてGα-LGN-NuMA複合体が広く知られている。しかし、全ての場合においてこの複合体が主要因子として機能するわけではないので、注意が必要である。 参考文献生化学 84, 81-91, 2012 |
| 細胞膜と形質膜 |
|---|
| 【plasma membrane】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| 細胞膜は,plasma membraneあるいはplasmalemmaの日本語訳である。より直訳に近い形質膜という言葉も使われるが,細胞膜がすでに長年定着している。ときとして,cell membranesという一般的な語の訳として用いられ,生体膜全般を意味するような用法を見ることがあるが,大きな混乱を招くのでこれは避けるべきだろう。 |
【し】
| CD分子 |
|---|
| 【Cluster of differentiation (CD) molecules】 |
| 大野 博司 |
| 理化学研究所・横浜研究所 免疫アレルギー科学総合研究センター(RCAI) |
| お問合せ |
| いくつかのモノクローナル抗体が、細胞表面の同じ抗原を認識することがあるので、混乱を避ける為にそうした抗体群を、同じ番号・記号で国際的に統一的に分類したものCD分類と呼ぶ。転じてモノクローナル抗体群が認識する同一の細胞表面抗原の名称にも用いられ、CD分子 (CD抗原)と呼称される。数年に一度開催される、human cell differentiation molecules (HCDM)のワークショップにより番号が決定され、2011年9月現在、CD1-CD350の350種類が決定されている。例えば、CD名CD1aは、CD1A抗原と記述され、CD1A抗原を認識するモノクローナル抗体のクローン名はLeu-6、O10、HI149の三種類である。いずれもHCDMのホームページに詳しい。(HCDM) 各モノクローナル抗体の供給先 (9社)も、CD分類別・モノクロナール抗体別に丁寧に記載され、リンクが貼られているので参照されたい。 |
| s-FDAP法 |
|---|
| 【s-FDAP (sequential FDAP) analysis】 |
| 木内 泰 |
| 東北大学大学院生命科学研究科 分子生命科学専攻 単分子動態生物学分野 |
| お問合せ |
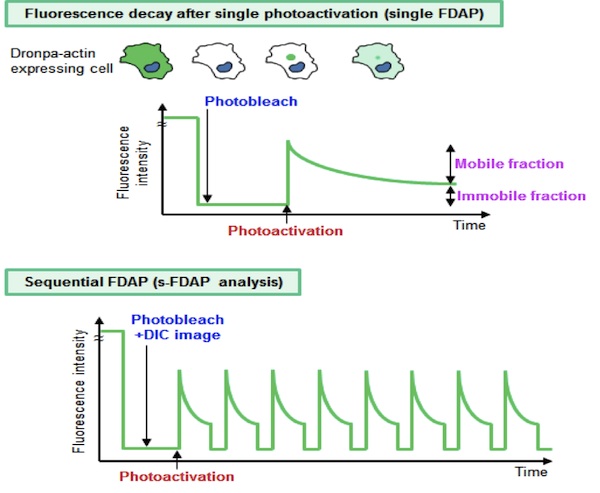
Dronpaは、AndoらによってクローニングされたGFP類似の単量体蛍光タンパク質である(1)。蛍光特性として、488nmの強いレーザー光で蛍光が消え(消光)、405nm又は458nmのレーザー光でその蛍光が回復し(光活性化)、光によって蛍光のスイッチのオン・オフを可逆的に繰り返すことができる。Dronpaをタグに付けたアクチンを細胞に発現させ、細胞全体で消光した後に一部で光活性化し、その後の蛍光強度の減衰を測定すれば、その減衰量は細胞質でのG-アクチン量を反映している(single FDAP)。そしてこの消光、光活性化、蛍光減衰の測定及び微分干渉像取得を繰り返すことで、細胞質のG-アクチン濃度の経時変化と細胞の形態変化を同一の細胞でモニターすることができる(s-FDAP analysis)(2)。
参考文献(1) Science, 306: 1370-1373, 2004. (2) J. Cell Biol., 193: 365-380, 2011. |
| ジフテリア毒素受容体 |
|---|
| 【Diphtheria toxin receptor (DTR)】 |
| 目加田 英輔 |
| 大阪大学微生物病研究所細胞機能分野 |
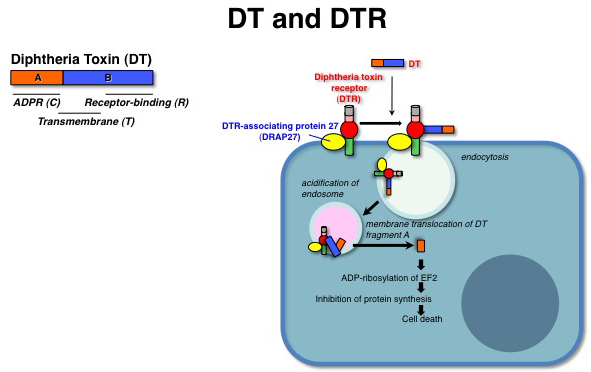
ジフテリア毒素(DT)は毒素活性を担うAフラグメントと受容体結合を担うBフラグメントからなる毒素分子である。DTは細胞表面のジフテリア毒素受容体(DTR)への結合を介してエンドサイトーシスされ、エンドソームの酸性化に伴うDTの構造変化によってAフラグメントがエンドソームの脂質二重膜を通過して細胞質に放出される。フラグメントAはペプチド伸長因子EF-2をADPリボシル化することで蛋白合成を阻害し、細胞を死に至らしめる。DTRの本体はEGFファミリーの増殖因子HB-EGFの膜型前駆体(proHB-EGF)である。ヒトやサルなどの細胞はDT感受性なのに対し、マウスやラットの細胞はDT抵抗性である。これはDTRのDT結合部位(proHB-EGFのEGF様領域)のアミノ酸の違いによるDT結合性の相違による。DTのDTR (proHB-EGF)への結合特異性は非常に高く、DTは他のEGFファミリーやマウス型HB-EGFには全く結合しない。DTRはテトラスパニンCD9と細胞膜上で複合体を形成することでその細胞表面量が増加するが、その機構は未だ明らかではない。 参考文献蛋白質核酸酵素 46, 506-511, 2001 |
| ジャスプラキノライド |
|---|
| 【jasplakinolide】 |
| 渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
Jasplakinolideは、海綿(Jaspis johnstoni)から単離された環状ペプチドである。アクチン線維の脱重合を阻害する。ファロイジンのアクチン線維への結合と競合する。ファロイジンなどの他のアクチン脱重合阻害薬とは異なり、細胞透過性があるため、生細胞内でのアクチン脱重合阻害薬として広く使用される。特に、ある細胞機能がアクチン重合-脱重合のダイナミクスに依存するか否かを検証するために頻用される。インビトロでは、ファロイジンとは違いアクチンの重合核形成を著明に促進し、伸長速度も2倍程度まで加速する。細胞に用いた場合、1〜3分でアクチン脱重合の阻害と単量体アクチンプールの減少が観察される。また、アクチン脱重合因子コフィリンやそのコファクターであるAIP1のアクチン線維への結合を阻害する。参考文献Bubb, M. R., Senderowicz, A. M., Sausville, E. A., Duncan, K.L.,Korn, E. D. (1994) J.Biol.Chem.269:14869-14871.
Bubb, M.R.,Spector,I.,Beyer, B. B., Fosen, K. M. (2000)J.Biol. Chem. 275: 5163-5170. Tsuji, T., Miyoshi, T., Higashida, C., Narumiya, S., Watanabe, N. (2009) PLoS ONE 4: e4921. > Kiuchi, T., Nagai, T., Ohashi, K., Mizuno, K. (2011) J. Cell Biol. 193: 365-380. |
| 小胞体とミクロソーム |
|---|
| 【microsomes】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| 小胞体はendoplasmic reticulum(細胞質中に広がる網状の構造の意)の日本語訳であり,ずいぶん本来の意味とニュアンスが異なっている。私見ではあるが,これはミクロソーム(microsomes)の直訳が転用され,定着したのではないかと思っている。ミクロソームは,細胞破砕液(homogenate)を分画遠心し,超遠心(100,000 x g, 1 h以上)で初めて沈殿する膜分画のことである。細かく破砕されて再び閉じた小胞体膜が最も多く含まれるが,ゴルジ体など他の細胞小器官も多く含まれるので,無論同義ではない。 |
| 小胞体ストレス応答 |
|---|
| 【ER stress response / Unfolded protein response】 |
| 吉田 秀郎 |
| 兵庫県立大学大学院生命理学研究科生体物質化学II講座 |
| 小胞体ストレス応答は、小胞体に立体構造が異常なタンパク質が蓄積した時(小胞体ストレス)に活性化される生体防御機構である。小胞体の重要な機能は、膜タンパク質や分泌タンパク質の立体構造形成である。分化などによって分泌タンパク質の産生量が増加すると、小胞体シャペロンによる分泌タンパク質のフォールディングが間に合わなくなり、小胞体内にフォールディングが未完成の分泌タンパク質が蓄積する。このような構造異常タンパク質の蓄積(小胞体ストレス)は細胞死を引き起こし、アルツハイマー病やパーキンソン病、糖尿病などのフォールディング病を引き起こす。細胞は小胞体ストレス応答を活性化することによって、小胞体ストレスに対抗し、細胞死から身を守ろうとする。
哺乳類の小胞体ストレス応答は3つの応答経路から成っている。ATF6経路は、小胞体シャペロンの発現を制御する経路である。小胞体膜上に存在するセンサー分子pATF6(P)が小胞体ストレスを感知すると小胞輸送によってゴルジ体へ運ばれ、ゴルジ体に存在するプロテアーゼS1PとS2Pによって切断される。その結果、細胞質側の転写因子部分pATF6(N)が膜から遊離して核へ移行し、転写制御配列ERSEに結合して小胞体シャペロン遺伝子の転写を誘導する。 IRE1経路は、小胞体に蓄積した構造異常タンパク質を分解処理するERAD(ER-associated degradation)関連因子の発現を制御する経路である。IRE1経路のセンサー分子であるIRE1は小胞体膜上に存在し、小胞体ストレスを感知するとオリゴマー化して活性化し、XBP1の前駆体mRNAを新規のmRNAスプライシング機構である細胞質スプライシングによって成熟型mRNAに変換する。成熟型mRNAからは活性型転写因子pXBP1(S)が翻訳され、pATF6(N)とともに転写制御配列UPREに結合することでERAD因子遺伝子の転写を誘導する。XBP1の前駆体mRNAからもタンパク質pXBP1(U)が翻訳されており、不要になったpXBP1(S)に結合してその分解を促進したり、XBP1 mRNAの翻訳速度を低下させるとともに小胞体膜に結合することによってXBP1の前駆体mRNAを小胞体に繋留する機能を持つ。 PERK経路のセンサー分子であるPERKも小胞体膜上に存在しており、IRE1と同様に小胞体ストレスを感知するとオリゴマー化して活性化する。PEKRは細胞質部分にキナーゼ領域を有しており、小胞体ストレス時には翻訳開始因子であるeIF2のalphaサブユニットをリン酸化することによって翻訳を一時的に抑制し、小胞体内腔での異常タンパク質の蓄積を抑制している。また、PERK経路は転写因子ATF4の翻訳を誘導し、転写制御配列AAREを介して翻訳関連因子や抗酸化因子の転写を誘導する。またATF4は転写因子CHOPの転写誘導を介してアポトーシスの誘導にも関わっている。 参考文献Mol. Biol. Cell (2010) 21, 1435-1438
Curr. Opin. Cell Biol. (2011) 23, 135-142 Science (2011) 334, 1081-1086 |
| 上皮細胞 |
|---|
| 【Epithelial cells】 |
| 鈴木 厚 |
| 横浜市立大学大学院医学研究科 |
| お問合せ |
| 上皮細胞は多細胞生物の内的環境を外界から遮断する細胞層を形成する細胞である。体表面を覆う「表皮」、および臓器の管腔表面を構成する「粘膜」、血管等の内腔を覆う「内皮」などを構成する細胞の総称であり、成体の約50%の細胞に該当する。生体の内部環境を維持する上で重要な役割を果たすとともに、受精卵から多細胞生物が発生する際のダイナミックな形づくり(形態形成)の過程においても、重要な動的役割を果たす。 容易に類推できるように、上皮細胞が機能する上では、細胞間の接着が非常に重要である。その接着構造は、十分に機械的強度を有する細胞間接着を示す必要がある一方で、細胞間を通じた選択的な物質の透過性を示す必要もある。これらの要請を満たすために、「密着結合 tight junction」, 「接着帯 zonula adherens」, 「デスモゾーム desomosome」という(最初は電子顕微鏡によって形態学的に観察された)特有な接着構造を発達させている。特に、最初の2種の接着構造は細胞周囲を一周、連続してベルト様に形成されるのが大きな特徴である。そして、これらの構造が細胞内の細胞骨格系(特にアクチン骨格系、中間径線維系)と密接に結びついている(微小管との関連の解明は現在に至る研究課題である)。 上皮細胞が機能する上では、外界に接する細胞膜と内部環境に接する細胞膜の間で非対称性(上皮細胞極性)を発達させることも非常に重要であり、その発達機構は、上記細胞間接着構造とも非常に密接に関わっている。 上皮細胞の増殖と運動は細胞間の接着に大きく制御されており、接着の破綻(たとえばE-cadherinの発現低下)は上皮―間葉変換(epithelia-mesenchmal transition)に結びつき、発癌に結びつく大きな原因となる。実際に、ほとんどの癌は上皮性である。 上皮性(上皮極性)と幹細胞性との関係も、近年の研究において、大きく注目されている。 参考文献 |
| 上皮細胞の細胞間接着構造形成 |
|---|
| 【Development of the epithelial cell-cell junctions and actin cytoskeleton】 |
| 鈴木 厚 |
| 横浜市立大学大学院医学研究科 |
| お問合せ |
| 上皮細胞はその特有の機能を果たす必要性から、細胞周囲を一周取り囲む連続的な接着構造を2種類---密着結合(tight junction)、および接着帯(adherens junction)---を発達させている。これらの接着構造の発達の素過程は、confluentな単層の培養上皮細胞を一部、針等でスクラッチし、その傷が埋まる過程(wound healing)をライブセルイメージングで観察する実験などを通じて研究されてきた。
これまでに、上皮細胞においても、線維芽細胞にも見られるような点状の接着構造(dot-like adherens junction)が最初に形成され、それが次第に融合し、最終的に2種に分化した連続的な接着構造に発達することが明らかとされている。ただ上皮細胞では、この初期接着構造にE-cadherinだけでなく、将来タイトジャンクションを構成するclaudin, occludin, JAMなどの膜タンパク質がすべてrecruitされてくるという特徴がある。 この発達過程においては、初期の点状接着構造から細胞内部に伸長するアクチン線維、および、上皮細胞特有にみられる周辺部(peripheral)の環状のアクトミオシン線維の求心性の収縮力が重要な役割を果たしていることが分かっている。さらに、Rho, Rac, alpha-caten、さらには極性制御因子であるPAR-aPKCシステムもこの過程の進行に必須な役割をしている。ただ、いかなる分子機構でこの過程が進行するのかという点については、まだ多くが不明である。 参考文献 |
| 植物の微小管 |
|---|
| 【microtubule in plants】 |
| 村田 隆 |
| 基礎生物学研究所 生物進化研究部門 |
| お問合せ |
植物細胞の微小管はその構築様式に特徴を持つ。第一の特徴は細胞周期の進行にともなって様々な構造を作ることである。間期の細胞では微小管は細胞膜に沿って並ぶ(表層微小管列、cortical array)。M期が近づくと、微小管は将来の分裂面に沿って帯状に集積する(分裂準備帯、preprophase band)。紡錘体の極は収束せず、樽状の紡錘体ができる。細胞質分裂で細胞板ができる時には、微小管は細胞板を分泌するフラグモプラスト(隔膜形成体、phragmoplast)をつくる。表層微小管列は緑藻を含む多くの緑色植物に見られるが、分裂準備帯は陸上植物の体細胞、フラグモプラストは陸上植物とその近縁の藻類にのみ見られる構造である。第二の特徴は、中心体を持たず、微小管形成が細胞内の様々な場所で起こることである。表層微小管列においては既存の微小管上で新しい微小管が形成されることがわかっている。中心体の喪失は陸上植物の体細胞に見られる現象で、多くの緑藻は中心体を持つ。参考文献 |
| 植物ミオシン |
|---|
| 【plant myosins】 |
| 山本 啓一 |
| 千葉大学理学部生物学科 |
| お問合せ |
現在、ミオシンは二十数種に分類されているが、植物で働いているのはVIII型とXI型である。XIII型というミオシンがカサノリから発見されたがそれはXI型の一種と見なされることになった。VIII型は原形質連絡の開閉やエンドサイトーシスに関与し、XI型はオルガネラの輸送とそれに伴う原形質流動に関与すると考えられている。植物細胞は動物細胞と比べてサイズが桁違いに大きいので、細胞内の物質循環を拡散に任せるわけにはいかず、原形質流動という細胞質の流れを起こしている。この流れは、XI型ミオシンが、小胞体膜のネットワークを引きずりながら、アクチンフィラメント上を滑り運動することにより引き起こされる。車軸藻の節間細胞は長さが数cmもあり、その中では毎秒70マイクロメーターという速い原形質流動が起こっている。この流速は車軸藻ミオシンがアクチン上を動く速度そのものなので、車軸藻ミオシンは筋肉ミオシンの10倍以上の速さで動くことのできる世界一速いモータータンパク質と言える。動かない植物のミオシンが、動くことが特徴である動物の筋肉ミオシンより速いというのはどのような意味があるのだろう。実は、この速さゆえ、車軸藻ミオシンがATPの化学エネルギーを運動に変換する効率は低く、出せる力は筋肉ミオシンと比べるとかなり小さい。原形質流動を引き起こす力はあまり強くなくて良いので、車軸藻ミオシンはエネルギー変換効率を犠牲にして巨大細胞内での物質輸送の速さを追求したものと考えられる。モデル植物のシロイヌナズナにはVIII型ミオシン遺伝子が4、XI型ミオシン遺伝子が13存在する。シロイヌナズナXI型ミオシン遺伝子を1−2個ノックアウトしてもオルガネラの輸送速度や表現系に大きな変化は見られないので、ミオシン間で機能の重複があるようだ。推定される細胞内での役割と対応するように、VIII型ミオシンの酵素活性や運動活性はXI型ミオシンより低い。
参考文献Yamamoto, K.(2008) "Plant Myosins" Chapter 12 in "Myosins" Ed. by L. M. Coluccio Springer Netherlands Ito,K., Kashiyama, T., Shimada, K., Yamaguchi, A., Awata, J., Hachikubo,Y., Manstein, D. J., and Yamamoto, K. (2003) Biochem Biophys Res Commun, 312, 958-964. Yamamoto, K., Shimada, K., Ito, K., Hamada, S., Ishijima, A., Tsuchiya, T. and Tazawa, M. (2006) Plant Cell Physiol. 47, 1427-1431. 山本研究室ホームページ |
【す】
| スピニングディスク共焦点顕微鏡 |
|---|
| 【spinning-disk confocal microscope】 |
| 中野 明彦 |
| 東京大学大学院理学系研究科生物科学専攻 |
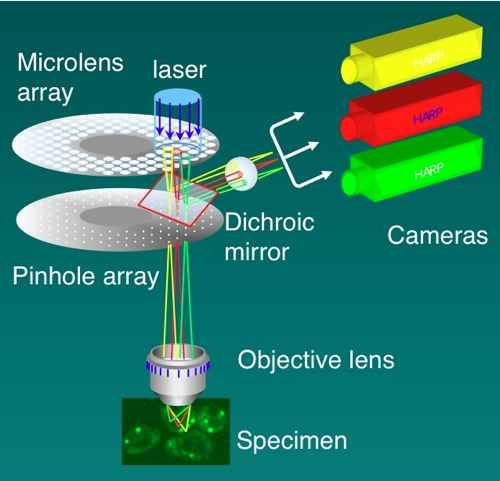
ニポウ板(Nipkow disk)式共焦点顕微鏡ともいう。小さな円盤に多数のピンホールを空け,高速で回転することによって試料を高速で走査する。横河電機が,ピンホールにレーザー光を効率よく導くためにマイクロレンズアレイを組み合わせて実用化した(図)。1000-2000フレーム/秒の高速性を誇る。同時に1000個程度の光点で試料を走査するため,ダメージが少ない,褪色しにくいなどの利点があり,また光学系は動かさないので実像を結び,高感度カメラで直接撮像できる。HARPカメラやEM-CCDカメラ,さらにイメージインテンシファイアなどとの組み合わせで,生細胞でも実際に1秒間に数百フレームの画像獲得が可能である。多色ダイクロイックミラー等を用いて複数種の蛍光プローブを完全同時観察でき,また高速性を生かしてオーバーサンプリングを行い,デコンボリューション処理することによって3Dで50-60 nmという超解像も実現されている。高性能なシステムは,SCLIM (Super-resolution Confocal Live Imaging Microscope)と呼ばれている。他の超解像顕微鏡に比べて,時間軸でも高い分解能を有することが特徴で,微細構造の高速な運動を追うライブセルイメージングの目的に適している。参考文献1. Nakano, A. (2002). Spinning-disk confocal microscopy -- a cutting-edge tool for imaging of membrane traffic. Cell Struct. Funct. 27:349-355. 2. Nakano, A. and Luini, A. (2010). Passage through the Golgi. Curr. Opin. Cell Biol. 22:471-478. 3. Matsuura-Tokita, K., Takeuchi, M., Ichihara, A., Mikuriya, K., and Nakano, A. (2006). Live imaging of yeast Golgi cisternal maturation. Nature 441:1007-1010. 4. Okamoto, M., Kurokawa, K., Matsuura-Tokita, K., Saito, C., Hirata, R., and Nakano, A. High-curvature domains of the endoplasmic reticulum (ER) are important for the organization of ER exit sites in Saccharomyces cerevisiae. J. Cell Sci. in press. |
| スペックル顕微鏡 |
|---|
| 【Fluorescent Speckle Microscopy】 |
| 渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
Waterman-StorerとSalmonがみいだした細胞骨格動態の蛍光顕微鏡撮影法。1996年、彼らが蛍光標識チュブリンを細胞にマイクロインジェクションしていたところ、低濃度で標識された細胞では、微小管がまだら(speckled)にみえ、微小管の軸方向への移動が可視化されたことの発見に端を発する。光の回折限界である0.2-0.3 ミクロンの領域に2-8個の蛍光標識が存在する場合、その数の確率的ばらつきから蛍光の強弱が生ずるが、それを可視化できる高感度の冷却CCDカメラが普及したことが本法の発見につながった。当初は、蛍光標識体のフォトブリーチング法よりも長時間にわたり、より高い時空間解像度で、微小管やアクチンネットワークの細胞内移動速度や方向を可視化する方法として利用された。後に、更に低密度の標識体をもちいて、細胞内アクチンを1分子ごとに可視化する単分子スペックル顕微鏡に発展し、アクチン線維の重合・脱重合やその制御分子の細胞内動態の可視化解析に用いられた。また、密度の高い標識の動態をコンピューター解析することで、細胞骨格分子や細胞接着分子の動態の全体像を迅速にとらえるqFSM法(quantitative Fluorescent Speckle Microscopy)がDanuserらによって開発された。(qFSM法については、結果に部分的にエラーが含まれる可能性も指摘されている。)参考文献 Salmon, E. D., Waterman, C. M. (2011) Mol. Biol. Cell. 22: 3940-3942.
Waterman-Storer, C. M., Salmon, E. D. (1997) J. Cell Biol. 139: 417-434. Watanabe, N., Mitchison, T. J. (2002) Science 295: 1083-1086. Danuser, G., Waterman-Storer. C. M. (2006) Annu. Rev. Biophys. Biomol. Struct. 35: 361-387. Vallotton, P., Small, J. V. (2009) J Cell Sci. 122: 1955-1998. |
【せ】
| セプチン |
|---|
| 【Septin】 |
| 上谷 大介・木下 専 |
| 名古屋大学大学院理学研究科 生命理学専攻 情報機構学講座 |
| お問合せ |
セプチンは細胞質分裂(septation)・細胞極性・細胞形態の異常を呈する出芽酵母変異体の責任蛋白質として同定された重合性GTP結合蛋白質とそのホモログの総称である。セプチンファミリーはRas様のGTP/GDP結合領域をコアドメインとして共有し、多くはカルボキシル側にコイルドコイル配列を持つ。セプチン遺伝子は菌類からヒトまでの真核生物で進化的に保存され、出芽酵母では7種類、線虫では2種類、ショウジョウバエでは5種類、マウスでは13種類、ヒトでは14種類存在するが植物には存在しない。セプチンは多様な組み合わせでフィラメント状ヘテロオリゴマーを形成し、さらに環状線維束を形成したり人工リン脂質膜上で2次元格子を形成するなど独特の高次集合性を持つ。セプチンを主成分とする環状構造体としては出芽酵母の分裂溝直下に形成されるセプチン・リング(septin ring)がよく研究されてきた。セプチン・リングは細胞周期進行および細胞質分裂関連分子を集積させる足場(scaffold)としての役割と、細胞膜および内膜系上を流動する膜蛋白質の非対称性分布を保つ拡散障壁(diffusion barrier)として母-娘細胞を区画化する役割を持つことが報告されている。細胞質分裂の分子機構は種間・系譜間の多様性が著しく、セプチン・リングが明確に同定できない場合も多いが、セプチンの要求性は種を超えて保存されている。多細胞生物におけるセプチンの発現はむしろ分裂後の細胞に多いため、細胞質分裂以外の機能に興味が持たれている。哺乳類においては、精子鞭毛内(輪状小体)と繊毛基部の細胞膜直下にセプチンを主成分とすると推測される環状構造体が存在し、足場・拡散障壁機能以外に細胞表層剛性維持機能を持つことが示されている。哺乳類のセプチンの一部は非筋型ミオシンと相互作用することにより、アクトミオシンを主成分とする収縮輪やアクチンストレス線維(actin stress fiber)の維持に寄与するが、詳細は不明である。ヒトでは優性変異型SEPT9 が家族性神経痛性筋萎縮症の原因となるほか、パーキンソン病、統合失調症、精子無力症では複数のセプチンの量的・質的異常が随伴する。参考文献木下 専 蛋白質 核酸 酵素 54, 1150-1158 (2009)
Weirich CS, Erzberger JP, Barral Y. The septin family of GTPases: architecture and dynamics.Nat Rev Mol Cell Biol. 9(6):478-89, 2008. |
| 静的残留と動的逆送 |
|---|
| 【static retention】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| AからBへという2つの細胞小器官の間でのタンパク質の輸送過程で,Bに進む積み荷タンパク質とAに留まるレジデントタンパク質の選別の概念。レジデントタンパク質が,Aから運び出されることなく留まるメカニズムが静的残留(static retention),Bに一旦輸送されてからAに送り戻されるのが動的逆送(dynamic retrieval)である。歴史的には,BiPなど小胞体に局在するタンパク質のシグナルとしてKDEL配列が同定され,当初小胞体残留シグナルと呼ばれたが,のちにゴルジ体から逆送されるためのシグナルであることが証明されて,より一般的な小胞体局在化シグナルという呼び方に落ち着いた。なお,retrievalは「回収,検索」といった意味の言葉であり,回収シグナルという表現も使われる。これを逆送と訳したのは,retrograde transport(逆行輸送)を意識した意訳である。 |
【そ】
| 走化性とアクチン制御 |
|---|
| 【Chemotaxis and f-actin regulation】 |
| 上村 陽一郎・上田 昌宏 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
走化性(あるいはケモタキシス、chemotaxis)とは、細胞が外界の化学物質の濃度勾配を認識して示す誘因あるいは忌避運動のことである。走化性は多くの生物現象で重要な役割をもち、例えば、胚発生、神経回路の形成、あるいはがん細胞の原発巣からの転移(metastasis)に走化性が利用されている。特に白血球(leukocyte)の一つである好中球(neutrophil)が走化性により炎症あるいは感染部位へ集まることが昔からよく知られている。走化性研究には上記の好中球や微生物である細胞性粘菌(Dictyostelium discoideum)が用いられており、これらの細胞は進化的に離れているものの、その分子機構はよく似ている。走化性物質(chemoattractantあるいはchemorepellant)は7回膜貫通のGタンパク質共役型受容体(G protein coupled receptor)により感知され、三量体Gタンパク質(trimeric G protein)を介して下流の細胞運動装置を制御する。細胞は運動方向に顕著な極性をもち、細胞の前方では盛んにアクチン重合(F-actin polymerization)がおこり、仮足(pseudopod)形成が促進される。一方、細胞の後方ではミオシンII(MyosinII)が局在し、収縮力(contractile force)を発生することで、方向性のある細胞運動を効率的に制御すると考えられる。アクチン重合が細胞前端で局所的に起こるしくみは断片的にしか明らかでないが、リン脂質の一つであるホスファチジルイノシトール三リン酸(phosphatidylinositol(3,4,5)trisphospate)がメディエーターとして重要であると考えられている。参考文献 |

 HOME
HOME