- ホーム
- >
- 細胞生物学用語集トップ
- >
- 細胞生物学用語集【た行】
細胞生物学用語集【た行】
【た】
| タリン |
|---|
| 【talin】 |
| 辻岡 政経 |
| 大阪大学大学院理学研究科 |
| お問合せ |
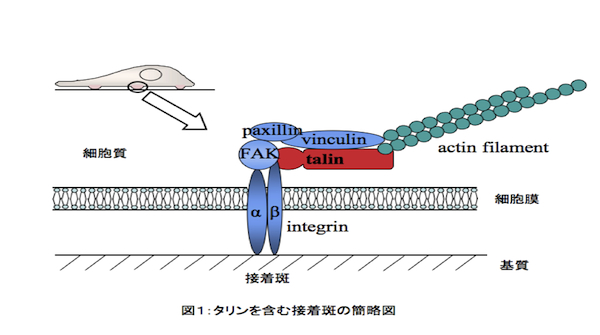
接着斑と呼ばれる細胞接着構造を構成する分子の一つ。およそ270kDaの大型のタンパク質で、FERMドメインと呼ばれる50kDa程度の球状領域と220kDa程度のロッド状領域からなる。脊椎動物は二つのタリン(talin)遺伝子を持ち、このうちの一方(talin1)について重点的に研究されてきた。接着斑では、接着分子であるインテグリン(integrin)が細胞外基質と結合し、その細胞質側でタリンをはじめ、多様なタンパク質と複合体を形成している(図1)。タリンはα鎖とβ鎖からなるインテグリンのβ鎖に結合して構造変化を引き起こし、接着可能な状態にすると同時にアクチンフィラメントにも結合して両者を繋ぐ。加えてアクチン結合タンパク質ビンキュリン(vinculin)やFAKキナーゼなどのタンパク質とも結合して複合体の核となり、接着斑の成熟、接着斑を介した細胞内外のシグナル伝達、力伝達に重要な役割を果たす。実際、talin1の機能を阻害した細胞は接着に異常を生じる。また、talin1欠損マウスは胚性致死である。近年ではもう一方のタリン(talin2)の解析も着手されており、両者の機能重複が報告される一方、性質の違いや異なる接着斑への局在など、特有の機能も示唆されている。タリンはホヤやショウジョウバエ、線虫、細胞性粘菌などにも広く存在する。なかでも粘菌は、二つのタリンの同時欠損株が単離されている唯一の生物であり、この変異細胞は基質に全く接着できない。さらに、この二つのタリンは粘菌の発生の異なる時期に働いており、タリンの機能の重複と特異性が示唆された最初の例である。参考文献 |
【ち】
| チューブリンの翻訳後修飾 |
|---|
| 【Post-translational modifications of tubulin】 |
| 池上 浩司 |
| 浜松医科大学 医学部 解剖学講座 |
| お問合せ |
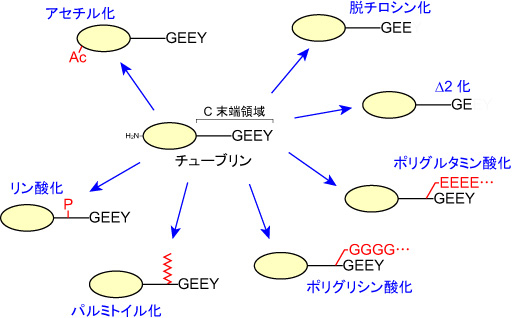
チューブリン(tubulin)は、アセチル化(acetylation)、リン酸化(phosphorylation)、パルミトイル化(palmitoylation)、脱チロシン化(detyrosination)、Δ2化、ポリグルタミン酸化(poly-glutamylation)、ポリグリシン化(polyglycylation)などの翻訳後修飾を受ける。アセチル化以外の修飾は、微小管(microtubule)表面に位置するチューブリンC末端領域に集中し、微小管表面の多様性を生み出す。修飾による微小管表面の多様性は、微小管と微小管結合タンパク質(MAPs)との相互作用に強い影響を与え、微小管の安定性や分子モーターの移動先などを制御する。参考文献 |
| 中間区画 |
|---|
| 【intermediate compartment】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| 基本的に,さまざまな輸送の過程で中間区画を考えることが可能であるが,単にこう呼ぶと,小胞体からゴルジ体への輸送の中間区画(ER-Golgi intermediate compartment: ERGIC, あるいは単にIC)を指すことが多い。形態的な特長からTVC(tubulovesicular clusters)と呼ぶこともある。明確に定義されるのは哺乳動物をはじめとする脊椎動物の細胞で,ゴルジ体が核近傍,中心体周辺に巨大なゴルジリボン(Golgi ribbon)と呼ばれる構造を形成する場合である。細胞中に広がる小胞体のネットワークから,直接このゴルジリボンへの輸送が起こるのではなく,細胞辺縁部にも存在する中間区画がまずはゴルジ体行きの積み荷を集め,それからゴルジリボンへと移行させていく。酵母や植物,無脊椎動物では,このような形での中間区画は存在しない。これらの生物種では,ゴルジ体がリボン構造を形成せず,個々に独立したゴルジ層板が多数細胞質中に広がるため,中間区画を経由しなくても小胞体からゴルジ体への直接の輸送が可能であるためではないかと考えられる。したがって,中間区画は一種の幼若なゴルジ体であると考えることも可能である。一方,哺乳動物の中間区画には小胞体ともゴルジ体とも異なる独自の機能が存在し,進化の過程で新たな機能を獲得したという考え方もある。 |
| 中間径フィラメント(中間径繊維) |
|---|
| 【Intermediate filaments (IFs)】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
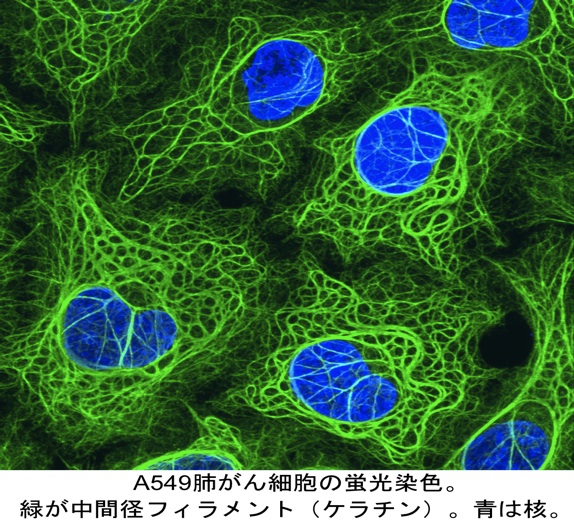
| 中間径フィラメント(fig1)は、アクチン繊維、微小管とならび細胞骨格を構成する主要3繊維の一つである。その名は、筋組織の電子顕微鏡観察においてミオシンIIの太いフィラメントとアクチンの細いフィラメントの中間の太さを示したことに由来するが(石川春律博士ら、文献1)、その太さ(10nm)はアクチン繊維と微小管の中間でもある。特徴として、これら3つの繊維の中では生化学的に最も溶けにくく、物理的には最も引っ張りに強い。そのため、細胞に機械的強度を付与していると考えられ、このことは変異動物や遺伝学の解析結果からも裏付けられている(教科書1, 2; 総説1; 以下同様)。
このような強い繊維構造は構成蛋白質同士が重合することによって構築される。その種類は複数あり、それぞれの相同性も互換性も低いが、構造的な類似によってフィラメント自体は同じサイズの似た性質となる。つまり、基本構造は長い棒状ドメイン(rod)とそれを挟む頭部(head)・尾部(tail)からなり、また重合に寄与する配列には保存性がある。 中間径フィラメントの種類についてみると、無脊椎動物にも類縁は存在するが少ない。一方、高等脊椎動物は中間径フィラメント構成蛋白質の種類が最も多く複雑である。それらは6つのグループに分けられ、重合できるグループは決まっている。さらにその発現に厳密な組織特異性が見られる。すなわち、ケラチン(keratin)は上皮細胞に、ビメンチン(vimentin)は結合組織細胞に、デスミン(desmin)は筋細胞に、GFAP (glial fibrillary acidic protein)はグリア細胞にそれぞれ発現する。 この特性は、医学領域においては腫瘍の分化マーカーとして利用されている。これを細胞生物学的に詳しく見れば、上皮の中間径フィラメントとしてのケラチンの特異性は高いが、そのサブタイプは20を超える。また、神経、筋、結合組織ではビメンチンをはじめ重なり合って発現する他の蛋白質がいくつかある。この冗長性が、中間径フィラメントの機能解析を困難にしている。 しかし近年の実験技術や遺伝子工学の進展により、各中間径フィラメントに特異的に結合する蛋白質が同定されるようになってきた。その中には、細胞種特異的な機能とよく相関を示すものがある(総説1, 2; 文献2, 3, 3', 4, 4'; 中間径フィラメント結合蛋白質の項も参照)。このことから、中間径フィラメントはこれら結合蛋白質にとっての足場(scaffold)でもあり、高等脊椎動物にみられる細胞種特異的な発現は、それぞれの細胞特性の付与に貢献しているのではないかと考えられるようになり、新たな注目を集めている。 参考文献文献1) Ishikawa H, Bischoff R, Holtzer H. J Cell Biol. 1968 Sep;38(3):538-55.
文献2) Kim S, Wong P, Coulombe PA. Nature. 2006 May 18;441(7091):362-5. 文献3) Sugimoto M, Inoko A, et al. J Cell Biol. 2008 Oct 6;183(1):19-28. 文献3') "Research Highlight" Nat Rev Mol Cell Biol. 2008 Nov;9:825 文献4) Inoko A, Matsuyama M, et al. J Cell Biol. 2012 Apr 30;197(3):391-405. 文献4') "In Focus: Trichoplein keeps primary cilia silent" J Cell Biol. 2012 Apr 30;197(3):341. 教科書1) 細胞の分子生物学 第5版 第16章 細胞骨格, NEWTON PRESS 教科書2) ルーイン細胞生物学 第4部 細胞骨格 9 中間径フィラメント, 東京化学同人 総説1) Fuchs E, Cleveland DW. Science. 1998 Jan 23;279(5350):514-9. 総説2) Coulombe PA, Wong P. Nat Cell Biol. 2004 Aug;6(8):699-706. |
| 中間径フィラメントのリン酸化による構築制御 |
|---|
| 【Role of phosphorylation on the disassembly of IFs】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
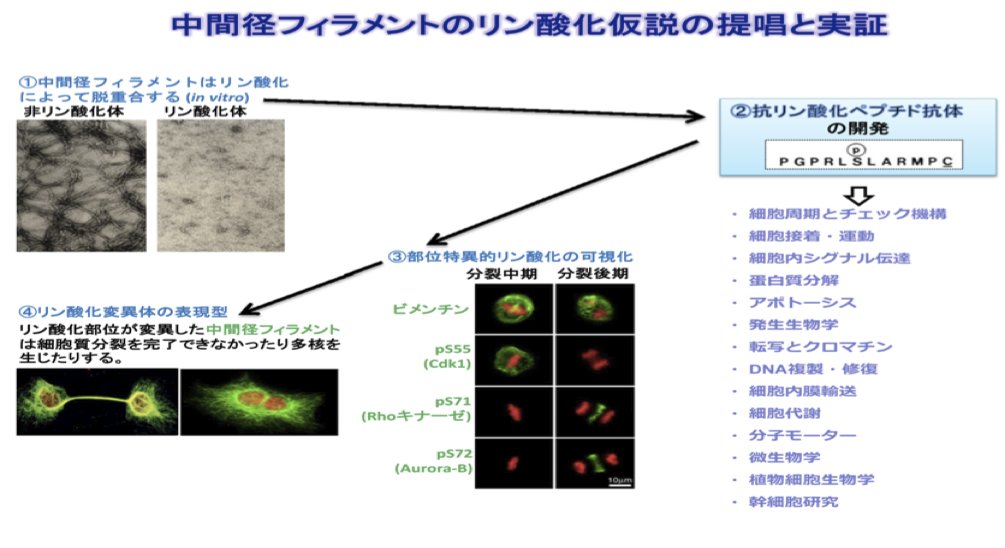
| 中間径フィラメント(中間径繊維と同義)はリン酸化により脱重合する。つまり、アクチン繊維や微小管と違い、基本的に濃度に依らない構築制御を受ける。そもそも中間径フィラメントは、非常に安定な不溶性の静的構造物と見なされていたため(中間径フィラメントの項を参照)、構築制御機構についての分子レベルでの理解は遅れていた。しかし1987年、稲垣昌樹博士ら(リンク1, 2)の報告により、中間径フィラメントの繊維構造がキナーゼによるリン酸化を受けて脱重合することがin vitroのビメンチン(vimentin)を用いた実験により明らかになった(fig1(1), 文献1)。この発見は、中間径フィラメントを動的な構造物として捉えなおす転機となり、従来の概念を変えたとされる。
この脱重合は細胞内現象として確認される必要があったため、アミノ酸残基のリン酸化を部位特異的に認識する抗体すなわち「抗リン酸化ペプチド抗体 (site- and phosphorylation state-specific antibody)」が同グループにより開発され、その作成から応用までが方法論として確立された(fig1(2), プロトコール1-3)。これらを用いた免疫染色により、ビメンチンが細胞分裂時に受ける複数の部位特異的リン酸化が可視化され、またそれぞれに特異的なキナーゼ(Cdk1, Rho-kinase, Aurora-B)が同定された(fig1(3); 総説1, 2)。さらにこのリン酸化部位を欠陥変異で置き換えると細胞質分裂が完了できなくなることを確認し(fig1(4))、このリン酸化による構築制御仮説は細胞現象、特に細胞分裂との関わりで実証された。 今、この方法論は細胞周期制御における重要なキナーゼカスケードの同定にも貢献している(fig1(2), 総説3)。 今後、このようなリン酸化変異体の影響を個体レベルで検討することが期待され、その研究は新展開を見せつつある。 参考文献リンク1) 愛知県がんセンター研究所・発がん制御研究部(稲垣昌樹研究室)
リンク2) 名古屋大学グローバルCOEプログラム 文献1) Inagaki M, Nishi Y, Nishizawa K, Matsuyama M, Sato C. Nature. 1987 Aug 13-19;328(6131):649-52. 総説1) Izawa I, Inagaki M. Cancer Sci. 2006 Mar;97(3):167-74. 総説2) 猪子誠人・後藤英仁, 中間径フィラメントの構築制御機構と細胞内機能, 細胞骨格と接着・蛋白質核酸酵素・2006年5月号増刊 (貝淵弘三・稲垣昌樹・佐邊壽孝・松崎文雄 編), 51, 551-558, 2006 総説3) 後藤英仁・稲垣昌樹, G2/M移行期におけるCDK1の活性化およびチェックポイント解除機構, 細胞周期フロンティア (佐方功幸・稲垣昌樹・岸本健雄 編),52-57, 共立出版, 2010 プロトコール1) Goto H, Inagaki M. Nat Protoc. 2007;2(10):2574-81. プロトコール2) 大海忍・辻村邦夫・稲垣昌樹 著, 抗ペプチド抗体実験プロトコール 新版, 秀潤社, 2004 プロトコール3) 後藤英仁・稲垣昌樹, Close Up実験法, 実験医学, 26, 2965-2972, 2008 |
| 中間径フィラメント結合蛋白質 |
|---|
| 【IF-associated proteins】 |
| 猪子 誠人・稲垣 昌樹 |
| 愛知県がんセンター発がん制御研究部 |
| お問合せ |
| 中間径フィラメント(中間径繊維と同義)に結合する蛋白質。アクチン繊維や微小管の結合蛋白質と同様、繊維構造の安定化や架橋をすることで調節的に働くものがある一方で、やや趣を異にするものがある。それは細胞種固有の機能に大きく関与するものである(総説1-5)。
例えば、ケラチン(keratin)は上皮特異的な中間径フィラメントである(中間径フィラメントの項を参照)が、実はアポトーシス(apoptosis)に関わる蛋白質を結合させることで、そのシグナルの減弱に寄与している(文献1)。また、ケラチン17(keratin17)は創傷など増殖状態にある表皮で発現するケラチンであるが、これが14-3-3σを結合させて、蛋白質の生合成を促進させていることが明らかとなっている(文献2)。また、アルバトロス(Albatross)は上皮細胞の極性化に寄与する新規蛋白質であるが、ケラチンはこの蛋白質に結合し、これを安定化することで上皮分化に促進的に働くことが示された(文献3, 3')。 このように、中間径フィラメントが足場(scaffold)となることで、細胞種固有の機能に貢献していることがわかってきた。つまり、中間径フィラメント構成蛋白質が顕著な組織特異的発現を示すのには意味があると思われる。特にケラチンはがんの発生母地である上皮に特異的に発現しているため、結合蛋白質の同定により上皮機能との関与を新たに探す試みは、対極にあるがん化の新規メカニズムの発見にもつながることから、医学的にも重要であると思われる(リンク1, 2)。 参考文献総説1) Fuchs E, Cleveland DW. Science. 1998 Jan 23;279(5350):514-9.
総説2) Coulombe PA, Wong P. Nat Cell Biol. 2004 Aug;6(8):699-706. 総説3) Izawa I, Inagaki M. Cancer Sci. 2006 Mar;97(3):167-74. 総説4) 井澤一郎・稲垣昌樹, 中間径フィラメントの構築制御とシグナルクロストーク, 形と運動を司る細胞のダイナミクス・実験医学・2006増刊 (竹縄忠臣・遠藤剛 編), 58-63 総説5) 猪子誠人・後藤英仁, 中間径フィラメントの構築制御機構と細胞内機能, 細胞骨格と接着・蛋白質核酸酵素・2006年5月号増刊 (貝淵弘三・稲垣昌樹・佐邊壽孝・松崎文雄 編), 51, 551-558, 2006 文献1) Inada H, Izawa I, Nishizawa M, Fujita E, Kiyono T, Takahashi T, Momoi T, Inagaki M. J Cell Biol. 2001 Oct 29;155(3):415-26. 文献2) Kim S, Wong P, Coulombe PA. Nature. 2006 May 18;441(7091):362-5. 文献3) Sugimoto M, Inoko A, et al. J Cell Biol. 2008 Oct 6;183(1):19-28. 文献3') "Research Highlight" Nat Rev Mol Cell Biol. 2008 Nov;9:825 リンク1) 愛知県がんセンター研究所・発がん制御研究部(稲垣昌樹研究室) リンク2) 名古屋大学グローバルCOEプログラム |
| 腸管ループアッセイ |
|---|
| 【ligated intestinal loop assay】 |
| 大野 博司 |
| 理化学研究所・横浜研究所 免疫アレルギー科学総合研究センター(RCAI) |
| お問合せ |
麻酔下の実験動物を用いて、生体組織の応答を、直接的に観察する実験手法。主に、パイエル板を含む小腸で行われる。まず、小腸のパイエル板を含む部分の両端を結紮し、生体条件に近い状態の閉空間を作る。この閉空間に試薬や菌液を充填し、組織との作用を観察する。組織が生きた状態でしか見られない応答(エンドサイトーシス等(1))を観察するのに適した手法である。参考文献(1)Hase, et al. nature (2009) |
| 超解像顕微鏡法 |
|---|
| 【Super-resolution Microscopy】 |
| 岡田 康志 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| 光が波としての性質(回折)を示すために、無限に小さな光源であっても、その光学顕微鏡像は波長の半分程度の大きさに滲んでしまう。可視光の場合、その大きさは200~300nmであり、これにより光学顕微鏡の分解能は規定される(回折限界 diffraction limit)。
近年、蛍光分子の特性を上手く活用することで回折限界を超える高い分解能を達成する技術が複数開発され、超解像顕微鏡法(super-resolution microscopy)と総称されている。現在よく知られている超解像顕微鏡法には、大きく分けて3つの種類がある。 1. 蛍光分子局在顕微鏡法(fluorescence localization microscopy) PALM/STORM/GSDIM (Photo Activation and Localization Microscopy, STochastic Optical Reconstruction Microscopy, Ground State Depletion and Individual Molecule return)と様々な名前が付けられているが、その基本的な原理は共通で、視野内の蛍光分子をランダムに個別に点滅させることで超解像を達成する。同時に点灯している蛍光分子の間隔が十分広ければ、各蛍光分子の位置の決定精度は画像のS/Nによって定まるので、回折限界以上の精度を達成することが出来る。これを多数回繰り返すことで視野内の蛍光分子すべての位置を決定し、その位置情報から画像を構築することで、超解像蛍光像が再構成される。そのため、分解能は、蛍光分子の位置決定精度で定まり、30 nm 以上の分解能が達成できる (fig1 画像1=通常蛍光像、画像2=PALM像 試料:微小管)。 この方法の発展型として、蛍光分子の明滅や消退による蛍光強度の揺らぎが蛍光分子を単位とする確率的な現象であることを利用して、蛍光強度の変動から超解像蛍光像を再構成する手法も開発されている(SOFI: Super-resolution Optical Fluctuation Imaging) 2. 構造化照明法(SIM: Structured Illumination Microscopy) SIMは、モアレ干渉を利用して特定方向の高分解能成分を取得する方法である。3方向×5位相の合計15枚の画像から再構成することで、x,y,zすべての方向で通常の蛍光顕微鏡の約2倍の分解能が達成できる。従って、例えばGFPなどの場合120 nm程度の分解能が期待できる。これは他の超解像手法顕微鏡法に比べると低い分解能であるが、蛍光色素の制約がないので、容易に多重標識の3次元超解像像を得られるのが特徴である。画像3(fig2)は、SIMによるミトコンドリア像。ミトコンドリアの内部構造を見ることが出来る。 3. 誘導放出制御法(STED: Stimulated Emission Depletion) STEDは、レーザー走査型コンフォーカル顕微鏡(CLSM: Confocal Laser Scanning Microscopy)の発展型である。誘導放出を利用してレーザーで蛍光が励起される点の大きさを回折限界以下に絞り込むことで超解像を達成する。従って、通常のCLSMと同様の操作で高速超解像イメージングが出来る。分解能は誘導放出制御光強度の平方根で決まり、およそ約50~80nmである (fig3 画像4:通常CLSM像、画像5:STED像 試料:EYFP標識F-actin)。ただし、使用できる色素には、励起光、蛍光、誘導放出光の3つがそれぞれ異なる波長の条件を満たす必要があるため、多重染色は困難である。 参考文献 |
【て】
| TRIOBP |
|---|
| 【TRIOBP】 |
| 北尻 真一郎 |
| 京都大学医学部附属病院耳鼻咽喉科 |
| お問合せ |
| T管 |
|---|
| 【T-tubule】 |
| 藤田 尚信 |
| 東北大学生命科学研究科 |
筋細胞内に張り巡らされた管状の膜構造体。横行小管とも呼ばれる。筋細胞膜が貫入した構造であり、筋細胞表面積の80%以上を占める。T管は、筋細胞内の至る所で筋小胞体と接触部位を形成し、筋小胞体からのカルシウムイオンの放出を制御する。1956年にGorge Palade博士らにより初めて報告された[1]。興奮収縮関連において、運動神経から筋細胞へ伝えられた活動電位は、T管を伝わり、筋小胞体からカルシウムイオンを放出させ、筋細胞の収縮を引き起こす。T管は効率的かつ同調した筋細胞の収縮に必要であり、その異常は骨格筋や心筋の不全につながることが知られている[2]。参考文献1. Porter, K.R., and Palade, G.E. (1957). Studies on the endoplasmic reticulum. III. Its form and distribution in striated muscle cells. J Biophys Biochem Cytol 3, 269-300. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2224093/
2. Al-Qusairi, L., and Laporte, J. (2011). T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet Muscle 1, 26. |
【と】
| トロポモジュリン |
|---|
| 【tropomodulin】 |
| 山城 佐和子・渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
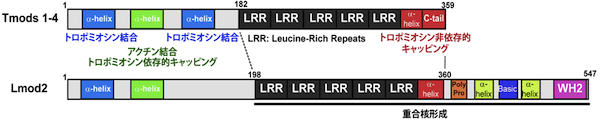
アクチン線維マイナス端 (矢じり端 または pointed end) キャッピングタンパク質。マイナス端に弱く結合する(解離定数= 約 0.1 μM)が、 アクチン結合タンパク質トロポミオシンにも結合し、トロポミオシンが結合したアクチン線維に対して強いキャッピング活性を示す(解離定数=約 0.2 nM)。海綿以後の多細胞生物で普遍的に存在し、酵母と植物では相同遺伝子は同定されていない。ほとんどの脊椎動物は4つの分子種(Tmod1-4) を持つ。生体内では、マイナス端キャッピング活性によりアクチン線維の安定性と長さを調節すると推測されており、心筋・骨格筋の筋原繊維形成、及び、赤血球・上皮細胞・レンズ繊維細胞のスペクトリン細胞膜骨格の形成と維持に関与する。ショウジョウバエ飛翔筋の筋原繊維と赤血球のスペクトリン細胞膜骨格では、アクチン繊維の長さ調節に関与する。培養細胞の細胞運動では、Tmod3 がラメリポディアに局在し、アクチン線維のダイナミックな再編成の調節に関与する。脊椎動物では、類縁のアクチン結合タンパク質にライオモディン (leiomodin, Lmod1-3) があり、N末端側のトロポモジュリン相同ドメインと、C末端側の アクチン結合WH2モチーフを含むドメインからなる (画像参照)。ライオモディンは強いアクチン重合核形成活性を持ち、この活性にはトロポモジュリン相同ドメインの一部 (leucine-rich repeats) とC末端側のドメインが必要である。横紋筋及び平滑筋に発現し、Lmod2 は筋原繊維形成に関与する。 参考文献Yamashiro S, Gokhin DS, Kimura S, Nowak RB and Fowler VM, Tropomodulins: pointed-end capping proteins that regulate actin filament architecture in diverse cell types. Cytoskeleton in press
Gokhin DS and Fowler VM, Tropomodulin capping of actin filaments in striate muscle development and physiology. J Biomed Biotechnol. 2011 Epub 2011 Oct 17. |

 HOME
HOME