原田 彰宏
大阪大学医学系研究科細胞生物学教室
概要・原理
カルシウム刺激によって細胞内のlysosomeが細胞膜に融合し、内容物を細胞培養液に放出する。Ionomycin刺激後、lysosome内の酵素であるN-acetyl-beta-D-glucosaminidase (beta-Hexosaminidase) の量を蛍光基質である4-methyl-umbellyferyl-N-acetyl-beta-D-glucosaminideを用いて測定する方法である。
装置・器具・試薬
4-methyl-umbellyferyl-N-acetyl-beta-D-glucosaminide (Sigma69585)
Ionomycin: (Calbiochem 407952)
Cytotoxicity Detection Kit PLUS (LDH) (Roche Diagnostics GmbH, Mannheim, Germany)
SH9000 spectrofluoremeter (Corona Electric Co.Inc., Ibaraki, Japan)
PBS (WAKO #045-29795)
CaCl2, Na2CO3, glycine, TritonX100, Na2HPO4, citric acid(ナカライ、WAKOなど)
細胞を固定、染色するのであれば
抗lamp1抗体:1D4B(Developmental Studies Hybridoma Bank)
Paraformaldehydeなど細胞の固定染色に必要な試薬一式
詳細
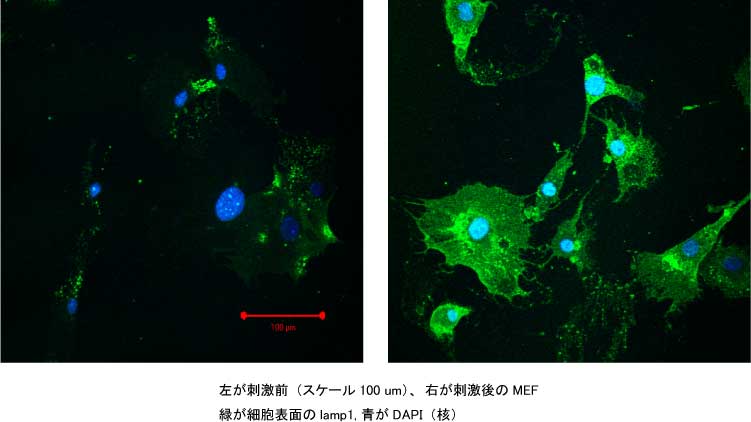
- 細胞を12well plateにConfluentに増やす*
- 2回PBSでwash*
- 0.5cc PBS (+1.2mM CaCl2)(negative control)か 0.5cc 1uM ionomycin in PBS (+1.2mM CaCl2) 300ulを加える*
- 2,5,10分後に上清を回収し、11000g 5min遠心して上清をアッセイに使用
- その後total cell lysateとして 残りの細胞を0.3ccの0.5%TritonX100 in PBS中で15分、37度incubateし、中身をチューブに回収して11000g 5min遠心し、その上清を使用
- アッセイ 4の上清の175ulに25ul of 4mM 4-methyl-umbellyferyl-N-acetyl-beta-D-glucosaminide in 20mM Na citrate-phosphate buffer, pH4.5を加える*
- 15min, 37C インキュベート
- 反応を 2M Na2CO3, 1.1M glycine 50ul を加えて停止する
- 蛍光をspectrofluoremeterで測定(excitation 365nm/ emission 450nm) (我々はSH9000 spectrofluoremeter (Corona Electric Co.Inc., Ibaraki, Japan) を使用した)
- 細胞中の全beta-NAGの測定 Cell extractを10倍希釈し、175ulをenzyme reactionに使う
- 写真を取りたければ、4の処理後3%PFA(in PBS)で固定してlamp1に対する抗体(1D4B)をかけて染色出来る(写真参照)。当たり前だが細胞膜表面のlamp1を見たいので可溶化はしない。
工夫とコツ
- MEFは不死化したものでも使えるが、ロットによってばらつくので、可能な限り初代培養のMEFを用いた方が良い。→他の実験でも不死化したMEFを用いる際は気をつけた方が良い。
- washの時のPBSは温める(冷たくても問題ないかもしれない)。 しかし3のCaCl2と、ionomycinが入ったPBSは温めるとカルシウムが析出するので出来るだけ冷えた状態で使用する(使用直前まで冷蔵庫に入れておく)。
- PBSにCaCl2を入れると沈殿を生じることがある。そうなると効果がなくなるので、我々は冷たいPBSに120mM CaCl2を1/100入れて、冷蔵庫でしばらく置いて沈殿しないことを確認後、ionomycinを加えて使用していた。また、作った PBS(+1.2mM CaCl2)と1uM ionomycin in PBS(+1.2mM CaCl2)は出来るだけ早く使用する(時間が経つと析出するためか効果が弱くなる)→ここが一番のポイント!!(DMSOに溶けたionomycinを直前に直接投与する人もいるので、出来るだけ直前と投与するというのは大事らしい)
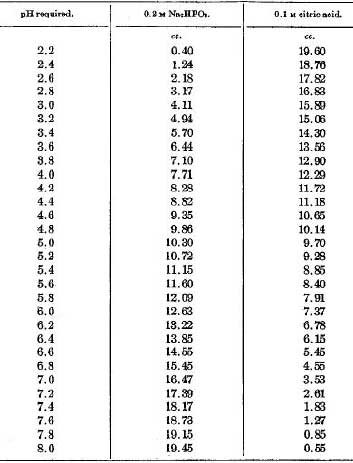
- Na citrate-phosphate buffer, pH4.5は、面倒だが下の表に従って、0.2M Na2HPO4と0.1M citric acidを混合してpHを合わせて作る。 試薬は4-4-methyl-umbellyferyl-N-acetyl-beta-D-glucosaminideストック溶液(250mg in 12.5ml DMF -20度保存)85.4ul, Na citrate-phosphate buffer, pH4.5 157ul, DDW 882.6ul を混合して合計1125ulで45回分になる。 残りの上清は細胞毒性を見るため、LDHの分泌量を調べる(Cytotoxicity Detection Kit PLUS (LDH) (Roche Diagnostics GmbH, Mannheim, Germany) を使用)。
- lysosomal exocytosisをみる方法としては、cell scraping assayという方法(細胞をかき取り、それを何度かblue tipで出し入れして損傷を与える)もあるが、これだと損傷が強すぎて上清中のLDHの値が非常に高くなる(つまり細胞へのダメージが大きい)ため、MEFのlysosomal exocytosisを見るには不適。
参考文献
The role of VAMP7/TI-VAMP in cell polarity and lysosomal exocytosis in vivo. Traffic. Jul 8. doi: 10.1111/j.1600-0854.2011.01247.x. (2011)



