浅沼 研、高須賀 俊輔、佐々木 雄彦
秋田大学大学院医学系研究科
概要・原理
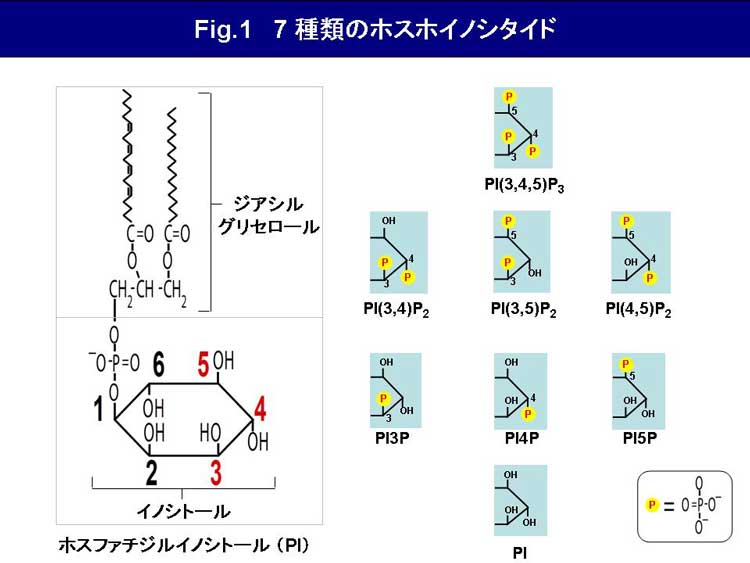
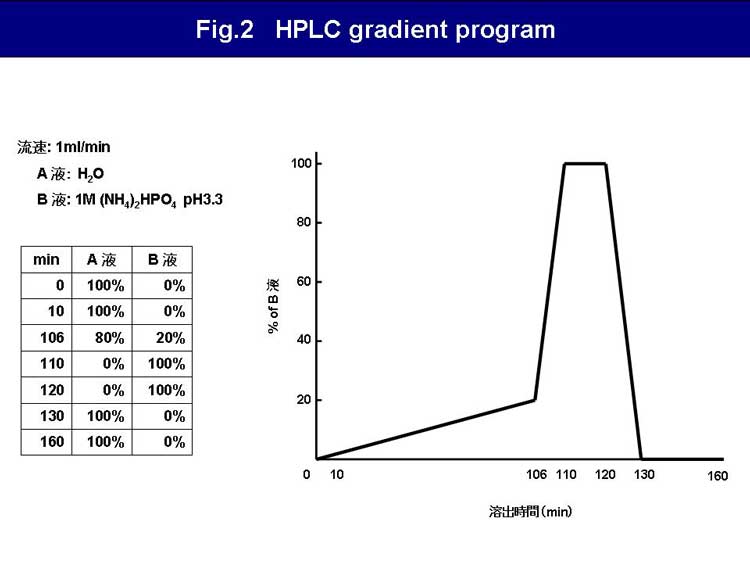
ホスファチジルイノシトール(PI)のイノシトール環3位、4位、5位水酸基は、様々なリン酸化酵素や脱リン酸化酵素の働きにより、可逆的なリン酸化の修飾を受ける。リン酸化の組合せによって生ずる7種類ホスホイノシタイドが、細胞に存在する(Fig.1)。 本ページでは、マウス胎児由来線維芽細胞を用いたホスホイノシタイドの定量方法について述べる。まず細胞を[3H]myo-inositolでRI標識し、その後Bligh-Dyer法により細胞からリン脂質を抽出する。抽出したリン脂質を脱アシル化して生成したイノシトールリン酸を、陰イオン交換カラムを用いた高速液体クロマトグラフィーにより分離する(Fig.2)。各イノシトールリン酸が溶出されるフラクションの放射活性を測定し、それぞれのホスホイノシタイドを定量するものである(Fig.3)。
装置・器具・試薬
推奨する製品に関しては()内にメーカー名及び製品コードを記載した。
機器
HPLC Pump(GLサイエンス、#GL-7410)
Auto Sampler(GLサイエンス、#GL-7420)
HPLC Column Partisphere SAX 4.6mm×125mm(Whatman、#4621-0505)
液体シンチレーションカウンター(ALOKA、#LSC-6100)
Flow Sintillation Analyzer(Perkinelmer、#FSA610)(※9)
遠心濃縮器(TAITEC、#A-0812-01)
真空ポンプ(ナビス、#AK-0220-0301-936-20)
冷却トラップ装置(東京理化器械、#UT80)
試薬
×10 inositol-free Medium(下に1ℓあたりの組成を示す)
| メーカー名 | 試薬名 | 重量(g) |
|---|---|---|
| 和光 | CaCl2・2H20 | 2.65 |
| ナカライ | Fe(NO3)3・9H20 | 0.001 |
| ナカライ | MgSO4・7H2O | 2 |
| 和光 | KCl | 4 |
| 関東化学 | NaCl | 64 |
| 和光 | NaH2PO4 | 1.09 |
| ペプチド研究所 | L-Arginine・HCl | 0.84 |
| ペプチド研究所 | L-Cysteine・HCl・H2O | 0.697 |
| 関東化学 | Glycine | 0.3 |
| 和光 | L-Histidine・HCl・H2O | 0.42 |
| ペプチド研究所 | L-Isoleucine | 1.05 |
| SIGMA | L-Leucine | 1.05 |
| SIGMA | L-Lysine・HCl | 1.46 |
| 和光 | L-Methionine | 0.3 |
| ペプチド研究所 | L-Phenylalanine | 0.66 |
| ペプチド研究所 | L-Serine | 0.42 |
| ペプチド研究所 | L-Threonine | 0.95 |
| ペプチド研究所 | L-Tryptophan | 0.16 |
| 和光 | L-Tyrosine | 0.72 |
| SIGMA | L-Valine | 0.94 |
| 和光 | Choline Chloride | 0.04 |
| 和光 | Folic Acid | 0.04 |
| SIGMA | Niacinamide | 0.04 |
| SIGMA | D-Pantothenic Acid Hemicalcium Salt | 0.04 |
| 和光 | Pyridoxine・HCl | 0.04 |
| 和光 | Riboflavin | 0.004 |
| Alexis biochemicals | Thiamine・HCl | 0.04 |
| ナカライ | D-Glucose | 45 |
×1 inositol-free Medium
×10 inositol-free Medium 100ml
×100 Gultamax(GIBCO) 10ml
フェノールレッド 0.0159g
NaHCO3 3.5g
1N HClにてpH7.2に滴定し、1ℓにメスアップ
0.22μmのアセチルセルロース膜で濾過滅菌
標識化合物inositol, myo-[1,2,-3H(N)]
(室町薬品株式会社、#ART0261AもしくはPerkinelmer、#NET906)
液体シンチレーションカクテルULTIMA-FLO AP(Perkinelmer、#6013599)
BSA(SIGMA、#A7030)
dialyzed FBS(BioWest、#S182D)
Perchloric Acid(和光純薬工業)
Chloroform(和光純薬工業)
Sodium Chloride(関東化学)
N-butanol(関東化学)
Methanol(ナカライテスク)
Methylamin 40% in water(ナカライテスク)
petroleum ether(ナカライテスク)
ethyl formate(ナカライテスク)
di-ammonium hydrogenphosphate(ナカライテスク)
詳細
15cm dishに細胞を播き込む8×105cells/10ml of Medium(inositol-free、10% dialyzed FBS)
↓ 4hインキュベーション(inositol starvation)
↓ 100μCiの[3H]myo-inositolをdishに加えてRI標識開始
↓ 72hインキュベーション(※1)
↓ Mediumを除去
↓ 10mlの氷冷PBS(-)でrinse×2回
↓ 10mlのMedium(inositol-free、FBS-free、0.1% BSA)を加える
↓ 2hインキュベーション(FBS starvation)
↓ 10% FCS、5min刺激
↓ on iceにてMediumを除去(※2)
↓ 10mlの氷冷PBS(-)でrinse×2回(※3)
↓ 800μlの2% HClO4を加える
↓ セルスクレーパーで細胞をかき集め15ml tubeに入れる(※4)
↓ tubeに3mlのCHCl3:methanol=1:2を加える
↓ vortex、30sec(※5)
↓ 室温(以下RTと表記する)、10minインキュベーション(※6)
↓ 1mlのCHCl3と1mlの2% HClO4を加える
↓ vortex、30sec
↓ 3,000rpm、RT、2min遠心
↓ 3層に分離するので上層(水層)と中間層(タンパク層)を除去
↓ 下層(有機層)に1mlのCHCl3-saturated 0.5M NaCl/1% HClO4を加える
↓ vortex、30sec
↓ 3,000rpm、RT、2min遠心
↓ 2層に分離するので下層(有機層)を新しい2ml tubeに移す
↓ evaporatorで遠心乾固
↓ 1mlの40% methylamine:H2O:methanol:n-butanol=24:16:40:10を加える(※7)
↓ 53℃で1hインキュベーション(脱アシル化)
↓ evaporatorで遠心乾固
↓ 800μlのH2Oと800μlのn-butanol:petroleum ether:ethyl formate=20:4:1を加える
↓ vortex
↓ 3,000rpm、RT、2min遠心
↓ 2層に分離するので下層(水層)をevaporatorで遠心乾固
↓ 130μlの10mM (NH4)2HPO4を加えてピペッティング
↓ 0.45μmのフィルターで濾過
↓ 濾過したサンプルから1.0μlをとり、液体シンチレーションカウンターで放射活性を測定する
↓ 比較するサンプル間のinputが揃うよう計算して10mM (NH4)2HPO4で適宜希釈(※8)
↓ HPLC Run(Fig.2)
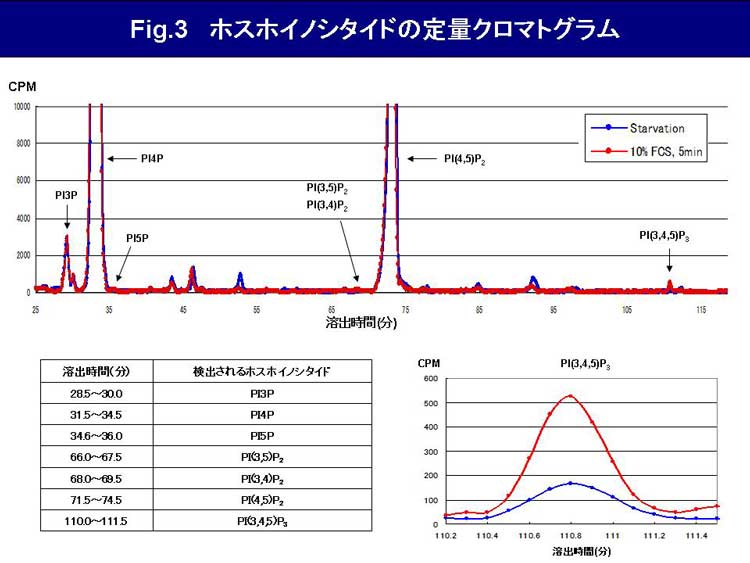
↓ 検出器にて放射活性を検出(Fig.3)
Fig.3 ホスホイノシタイドの定量クロマトグラムの解説
サンプル間のデータを比較するにあたり、各フラクションの放射活性が数値化された生データをノーマライズする必要がある。まず25.1~120分までの各フラクションの放射活性合計値を算出し、その値が1,000,000CPMになるように補正する。その後、三点移動平均法によるデータのsmoothingを行い、クロマトグラムに起こしている。
また、各ホスホイノシタイドの溶出位置は、使用するカラムのロットによって若干異なる。当研究室においては、in vitroで酵素反応により作製した標準品を用いて、各ホスホイノシタイドの溶出位置を同定した。
野生型マウス由来線維芽細胞を用いた本実験系においては、PI5P, PI(3,5)P2, PI(3,4)P2の存在量は検出限界以下である。また、PI(3,4,5)P3の細胞内存在量は定常状態では非常に低く抑えられているが、ホルモン等の増殖刺激に伴い一過性に産生され、その後速やかに代謝・分解される事が知られている。本実験系においても、血清刺激に伴い 細胞内でPI(3,4,5)P3が産生され顕著に増加している事が確認出来る。
工夫とコツ
※1 胎児由来線維芽細胞はロットにより増殖速度が異なる。その為、細胞がオーバーコンフルエントになるようであれば、RI標識の時間を短縮するか、播き込む細胞数を調整する事で対応する。
※2 ホスホイノシタイド が代謝・分解されることを防ぐ為、氷上で作業すること。
※3 PBS(-)がdishに残らないよう、アスピレーターもしくはピペットマンでしっかりと除去する。残存した PBS(-)が多いとその後の工程で有機層と水層が一層に混じり合わない。
※4 15ml tubeはガラスチューブを用いるべき操作ではあるが、本実験ではポリプロピレンチューブを用いても大きな支障は無く、また、後の処理(洗浄操作、廃液処理など)が楽である。
※5 この段階で透明な一層の液にならず白濁している場合は、PBS(-)の除去が不完全であったと考えられる。その場合は液が透明になるまでmethanolを少量追加する。
※6 低温では二層の分離がうまくいかない。室温(20℃~30℃)での作業が良い。
※7 作り置き不可。毎回必要量を用事調製すること。
※8 当研究室ではHPLCに用いるサンプル液量を100μlにしてる。サンプルにもよるが、PI(3,4,5)P3を検出対象とする場合、3,000,000CPM/100μl以上のinputが望ましい。
※9 Flow Sintillation Analyzerが無い場合は、フラクションコレクターを用いて溶出液を250μl/fractionで分取し、液体シンチレーションカクテルを加えて液体シンチレーションカウンターで放射活性を測定する事も可能である。
参考文献
L. A. Serunian, K. R. Auger, and L. C. Cantley, Identification and quantification of polyphosphoinositides produced in response to platelet-derived growth factor stimulation. METHODS IN ENZYMOLOGY 198 (1991) 78-87.



