高島 皓平、中井 和香、中山 和久
京都大学薬学研究科生体情報制御学分野
概要・原理
siRNAを用いてノックダウンを行う場合、特定の配列のオリゴヌクレオチドを用いることが多い。配列によっては強力なノックダウン効果が期待できるものの、配列が適切でない場合、効果的にノックダウンすることができない。ここでは、リコンビナントのDicerを用いてsiRNAを作製する方法を紹介する。本法は、500-1000bp程度の配列をターゲットとして二本鎖RNAを合成し、それをDicerで切断することでsiRNAを作製するものである。様々な配列のsiRNAの混合物となるため、ほぼ確実に適切な配列が含まれ、ノックダウンが失敗することが少ないことが利点である。また、オリゴヌクレオチドの場合には、同じ配列のsiRNAを大量に用いるため、無視できないオフターゲット効果が出ることが少なくない。一方、本法では、同じ配列のsiRNAは少量ずつしか含まれないため、強いオフターゲット効果は出にくいと考えられる。
装置・器具・試薬
BLOCK-iT RNAi TOPO Transcription Kit (Invitrogen)
PowerCut Dicer (ThermoScientific)
PureLink miRNA Isolation Kit (Invitrogen)
エタノール
b-メルカプトエタノール
詳細
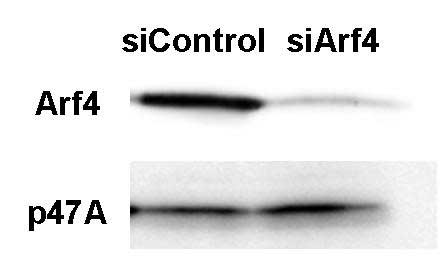
- ノックダウンに用いる配列(500-1000bp程度)を決定する。BLASTなどを用いて、オフターゲット効果が出にくいと考えられる領域を選ぶ。
- 選択した領域を含む配列をクローニングする。
- BLOCK-iT RNAi TOPO Transcription Kit (Invitrogen)を用いて、二本鎖RNAを作製・精製する。
- PowerCut Dicer(ThermoScientific)の説明書に従い、精製した二本鎖RNAを切断する。スケールは調節可能であると思われる。
- 切れ残った長鎖の二本鎖RNAは免疫応答を惹起するため、除去する必要がある。PureLink miRNA Isolation Kit(Invitrogen)など、短いRNAを精製可能なRNA精製キットを用いて、切断されたRNAのみを精製し、濃度を決定する。
- Lipofectamine2000(Invitrogen)などのトランスフェクション試薬を用いて、細胞にトランスフェクションする。
工夫とコツ
オリゴヌクレオチドでノックダウンする場合の様に、点変異を入れたコンストラクトで回復実験を行うことは、原理上不可能である。しかし、ターゲット配列を5’あるいは3’非翻訳領域に設定しておけば、回復実験は可能である。; Dicerの反応スケールが小さい場合、その後の精製でなぜか夾雑物が多く入るようであった。Dicer反応後に、RNase-free waterでスケールアップしてから精製すると、改善できた。; 当研究室では、HeLa細胞のノックダウンの場合、6wellプレートで250-1000ng程度のsiRNAを用いている。トランスフェクション時の細胞の密度を60-70%程度にすると、トランスフェクションの効率と細胞毒性の回避が両立できる。トランスフェクションの翌日に細胞をまき直し、トランスフェクション後72時間の時点で実験を行うことが多い。効果が不十分な場合、まき直した次の日に2回目のトランスフェクションを行い、その翌日にさらにまき直して、1回目のトランスフェクション後、通算120時間後に実験する。
参考文献
BLOCK-iT RNAi TOPO Transcription Kit 取扱説明書
PowerCut Dicer 取扱説明書
PureLink miRNA Isolation Kit 取扱説明書



