國井 政孝
大阪大学医学系研究科細胞生物学教室
概要・原理
1/2 Karnovsky固定液にて灌流固定を行った組織を四酸化オスミウム、酢酸ウラニルで後固定ならびに電子染色を行い、脱水してエポキシ樹脂に包埋、重合させる。
装置・器具・試薬
器具
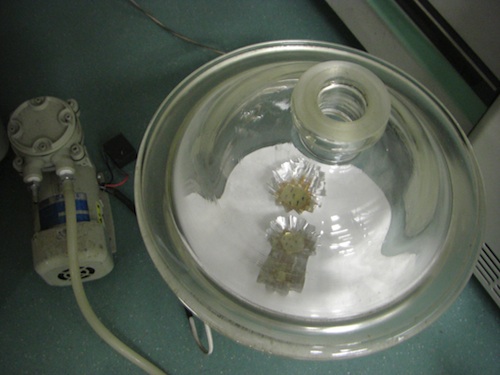
デシケーター【fig.4】:下にシリカゲルを敷いたpropylene oxideを揮発させるためのもの【fig.4】と、eponの中の空気を抜くためにポンプにつないだもの【fig.5】の2つ必要
真空ポンプ【fig.5】
アルミカップ【fig.3】:アルミの厚めの製菓用のもので可(propylene oxideを少し入れてみて漏れないようならよい)
有栓メスシリンダー(eponの作成に使用):蓋がすりガラスなどになっていてeponが漏れないよう、しっかり閉まるもの
シリコンプレート(日新EM、堂阪EMなど。ビームカプセルの作成に使用)【fig.7】
試薬
10% sucrose / 0.1M cacodylate buffer
*20% sucrose溶液と0.2M cacodylate buffer(cacodylic acid sodium salt 粉末(nacalai tesque)をDDWに溶解し、HClでpHを7.4に調整)を1:1で混ぜる。
1% osmic acid / 0.1M cacodylate buffer
*2% osmic acid(日新EM)と0.2M cacodylate bufferを1:1で混ぜる。
0.5% uranil acetate; ethanol(65%, 75%, 85%, 95%, 99%, 無水)
propylene oxide(和光純薬など)
Epon (Quetol 812 セット: 日新EM)
*有栓メスシリンダーにQuetol812 45.5ml、DDSA 31ml、MNA 23.5mlを入れてパラフィルムで口をよくまいて漏れないようにしたあと、メスシリンダーを上下にぐるぐる回して30分撹拌した後【fig.8】、DMP-30を1.5ml加えて5分間激しく撹拌する。撹拌の早さが遅いと部分的に重合してしまうので注意。混ざった所は色が変わるので分かる。混ざったら-80℃保存し、必要な時に室温に戻して再使用可。
詳細

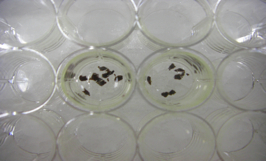





- 1/2 Karnovsky(2.5% glutaraldehyde, 2% paraformaldehyde, 0.1M cacodylate buffer)を用いて固定した組織片を24穴プレート(または下記4のバイアル瓶でもよい)に入れ、10% sucrose / 0.1M cacodylate bufferで洗う。氷上、5分。【fig.1】
- 1% osmic acid / 0.1M cacodylate bufferで組織を後固定する。氷上、1時間。【fig.2】 *1時間以上は決しておかないこと(蛋白を破壊するため)
- DDWで3回洗浄した後、0.5% uranil acetateに浸ける。2時間~オーバーナイト。 その日に脱水まで行いたい場合は1% uranil acetateで1時間でもよい。
- ethanolを用いて脱水する。65%から99%まで室温で各5分程度。無水は20分を3回。その後、組織を24穴プレートからガラスのバイアル瓶に移し(propylene oxideによってプラスチックが溶けるため)、propylene oxideに浸ける。室温、20分2回。
- アルミカップにEponとpropylene oxideの等量混合液を入れ、その中に試料を浸ける。デシケーターに入れて一晩以上液量が半分くらいになるまで静置する(長くても3日位まで)。【fig.3,4】
- 新しいアルミカップにEponを入れ、混合液から試料を移す。デシケーターをポンプにつなぎ、4時間ほど脱気する。その後、新しいEponに移し、一晩脱気する。【fig.5】 *必ずしも新しいEponにする必要はないが、propylene oxideが残ると重合が不十分になってしまうため、安全のため1度新しいのに入れ替えるようにしている。
- アルミカップを65℃のインキュベータへ入れ、Eponを重合させる。36時間以上。
- 重合した後は糸のこぎりなどを用いて組織を切り出し、ボンドでビームカプセルに貼り付ける。【fig.6】 *ビームカプセルはシリコンカプセルにeponを流し込み、重合させて作成する。
工夫とコツ
組織片は大きいと脱水されにくいので、厚さが1-2mmくらいになるようにカットする。
1% osmic acid反応中に組織片を何度か撹拌する(そうしないと時々底に密着したところが固定されないままになってしまうことがある)。
1% osmic acidは揮発性かつ変性作用が強いため(手につくと黒くなる)、1% osmic acidを使用する際は手袋をしてドラフト内で行う。廃液は廃液入れに捨てる(出来れば1回目のwashの際のDWも)。
脱気中に組織片が液面に浮いて乾燥しないよう、しっかりと沈める。
エタノールによる脱水は99%の所で止められる。再度始める時は99%から始め、100%をしっかり20分x3回やる。また脱水は培養細胞等の場合は2,3分で十分だが、100%だけは同じ様に行う。
cacodylate bufferはヒ素を含むため、廃液を直接流しに捨てないこと(所属部局の廃液分類に従って捨てる)
参考文献
井関祥子、太田正人 編集 実験医学別冊 免疫染色・イメージングのコツ 羊土社



