田端 桂介
大阪大学大学院医学系研究科遺伝学教室
概要・原理
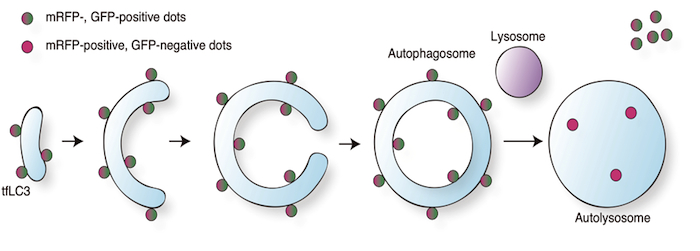
細胞内のLC3ドットが増加していたからといって、オートファジーが亢進しているとは結論づけられない。なぜならばオートファジーによる分解が阻害されていてもLC3の蓄積につながるからだ。そこでオートファゴソームの成熟過程(オートファゴソームとリソソームの融合過程、あるいは融合したあとオートリソソーム内での分解)を調べる事で、オートファジーの亢進と区別する事ができる。このオートファゴソームの成熟過程を調べるのに有用なのが、mRFPとEGFPをLC3へタンデムに融合したtfLC3である。この融合タンパク質のEGFPのシグナルはリソソーム内の環境下において蛍光が減弱するのに対し、mRFPは同環境下でも安定である(図)。colocalized dots/mRFP dotsの割合を比べる事でオートファゴソームの成熟過程への影響を評価する。
装置・器具・試薬
細胞培養液
Growth medium: Dulbecco’s modified Eagle’s medium (DMEM; D6546, Sigma) containing 10%
fetal bovine serum supplemented with 4 mM L-glutamine.
Starvation medium: Earle’s balanced salt solution (EBSS; E2888, Sigma)
カバーガラス
Matsunami glass; 12-mm round, NO. 1S thickness; 必要があればコラーゲンコートしたものを調製し使用する。
固定液
4% Paraformaldehyde solution (PFA)
50 mM NH4Cl/PBS
退色防止剤
SlowFade Gold antifade reagent: SlowFade Gold antifade reagent (Invitrogen, S36936)
詳細
- tfLC3トランスフェクション前日、細胞を6 well plateに播種し、CO2細胞培養器内で18-24時間培養する。
- 翌日、tfLC3のプラスミドを細胞へトランスフェクションし、CO2細胞培養器内で24時間培養する。
- 【飢餓処理によるオートファジー誘導】培養液を除去し、PBSで細胞を2回洗い、飢餓(アミノ酸、血清飢餓)培地であるEBSSを添加する。富栄養条件は通常のgrwoth mediumを加える。
- 用いる細胞に応じて1-4時間培養する。(例:MEFの場合1時間、A549細胞の場合4時間)
- 【固定】 培養液を除去し、細胞をPBSで1回洗った後、固定のために4% PFAを加え室温で15分静置する。
- 【Quenching】 PFAを除去し、細胞をPBSで2回洗った後、50 mM NH4Cl/PBSを添加し、室温で10分間静置する。
- 【Mounting】 カバーガラスをPBSで3回洗浄した後、5 μlの退色防止剤を滴下したスライドガラス上にカバーガラスをのせ、余分な液をろ紙等で除去する。その後、爪に塗るマニュキュアを用いて、カバーガラスを固定する。
- 【保存】 遮光して4℃保存
- 顕微鏡を用いて観察
工夫とコツ
必要があれば、tfLC3と同時に他のプラスミドもトランスフェクションして評価する事も可能である。
ネガティブコントロールについて
ネガティブコントロールを実験に入れる事は、結果を正しく判断する上で重要である。ネガティブコントロールとしてオートファゴソーム形成阻害の報告のあるwortmanninなどを使用することで、tfLC3でラベルされたオートファゴソームと凝集塊を区別することができる。
参考文献
Mizushima N., Yoshimori T., and Levine B. (2010). Cell 140, 313–326.
Klionsky, D. J., et al. (2008). Autophagy 4, 151–175.
Kimura S., Noda, T. and Yoshimori T. (2007). Autophagy 3, 452-460.
Tabata K., et al., Cell Imaging Techniques: Methods and Protocols, 2011



