遠藤 剛千葉大学大学院理学研究科
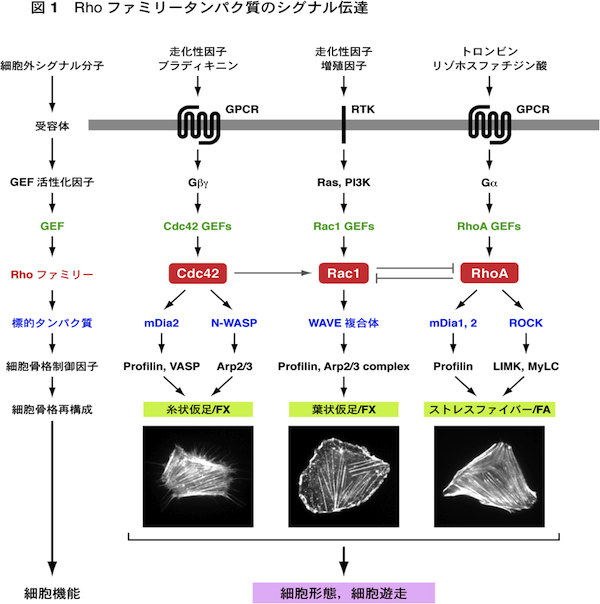
細胞内のアクチン細胞骨格と微小管はダイナミックに変化するが,その制御の中心的な役割を担っているのがRhoファミリー低分子量Gタンパク質である.哺乳類ではRhoファミリータンパク質は約20存在するが,これらのうちで特にRhoA, Rac1, Cdc42についての研究が進んでいる.これらはいずれも,細胞外のシグナル分子とそれらの受容体により活性化されたGDP/GTP交換因子(GEF)が作用して活性化される.すなわち,GDPを結合した不活性化状態からGTPを結合した活性化状態に変換される.活性化されたRhoファミリータンパク質は,標的タンパク質(エフェクタータンパク質)に結合して作用を現す.またGTPを結合したRhoファミリータンパク質にGTPase活性化タンパク質(GAP)が作用すると,GTPase活性が促進されてGTPを加水分解し,GDPを結合した不活性化状態にもどる. Cdc42は標的タンパク質のmDia2やN-WASPを介して,束状のアクチン線維を形成し,糸状仮足(filopodia)の形成を引き起こす.またRac1は標的タンパク質のWAVE複合体を介して,枝分かれしたアクチン線維のネットワークを形成し,葉状仮足(lamellipodia)の形成に働いている.RhoAは標的タンパク質のmDia1を介してアクチン線維を形成し,またROCK(Rhoキナーゼ)を介してアクチン・ミオシン相互作用を引き起こす.これによりストレスファイバーとフォーカルアドヒージョン(接着斑)の形成がもたらされる.走化性因子に向かって細胞が遊走する場合には,細胞前方(先導端)に形成される糸状仮足が走化性因子を含む細胞周辺の環境を探り,また葉状仮足が細胞体の移動に働く.さらにストレスファイバーが細胞後方(尾部)の退縮に働く.こうしてCdc42, Rac1, RhoAが時空的に協調して働くことにより,細胞遊走がもたらされる. 遊走している細胞は前方が広がった扇状の形態をとる.このような細胞では,核の前方に微小管形成中心(MTOC)が配置して,そこから微小管が伸長・短縮している(動的不安定性).微小管が伸長するプラス端は細胞前方に配向し,アクチン線維やフォーカルアドヒージョンに結合すると安定化する.Cdc42とRac1は標的タンパク質のPar6, IQGAP1, PAKを介して,核前方へのMTOCの配置,および微小管の安定化や細胞膜への結合に働く.またRhoAもmDia1, mDia2を介して微小管の安定化に働く.このようにCdc42, Rac1, RhoAは遊走細胞の極性(方向性)の形成にもかかわっている.
参考文献
(1) 渡邊晴子,高野和儀,遠藤 剛 (2006) 蛋白質 核酸 酵素 増刊「細胞骨格と接着」,51, 683-692.
(2) Jaffe, A.B., Hall, A. (2005) Annu. Rev. Cell Dev. Biol. 21, 247-269.
(3) Rottner, K., Stradal, T.E. (2011) Curr. Opin. Cell Biol. 23, 569-578.



