福原 茂朋・望月 直樹国立循環器病研究センター研究所 細胞生物学部
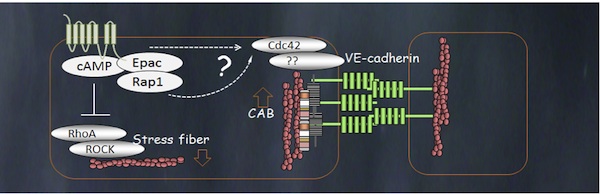
cAMPがA-キナーゼではなく、Epac (低分子量GTP結合蛋白質Rap1のグアニンヌクレオチド交換因子)の活性化によりGTP-Rap1を増加させる。さらにCdc42の活性化が生じるとともに、血管内皮細胞では、β/α-カテニンを介したVascular endothelial cadherin (VE-cadherin)とcortical actin cable (CAB)の結合が促進される。また一方、Rhoの抑制によるventral stress fiberの抑制も見られる。結果としてVE-cadherinの細胞間接着の安定化により、相対的に細胞-細胞間接着が増強され、細胞―基質間接着が減弱されることになる (図参照)。Rap1がどのようなシグナルでCdc42を活性化するのか?, Cdc42がいかにしてCABの形成を促進するのか?は不明である。Epacが発現する細胞種によってEpacの下流因子が変わるために(心臓ではRap1-PLCepsilon, 膵臓ではKチャンネルなど)アクチンの制御に関わるのがはっきりしているのはRap1-Cdc42系のシグナルが明らかな血管内皮細胞だけである。血管内皮細胞ではアドレノメデュリン受容体やアドレナリン受容体などのGs-アデニル酸シクラーゼ系を活性化するG蛋白質共役型受容体が発現するためにcAMP-Epacによるアクチン骨格制御系が機能する。A-キナーゼによるアクチン細胞骨格の直接制御についても上皮細胞・内皮細胞ともに明確な調節機構は明らかにされていない。
参考文献
1. Noda K, Zhang J, Fukuhara S, Kunimoto S, Yoshimura M, Mochizuki N. Vascular Endothelial-Cadherin Stabilizes at Cell-Cell Junctions by Anchoring to Circumferential Actin Bundles through a- and b-Catenins in Cyclic AMP-Epac-Rap1 Signal-activated Endothelial Cells. Mol Biol Cell. 21:584-96, 2010
2. Fukuhara S, Sakurai A, Sano H, Yamagishi A, Somekawa S, Takakura N, Saito Y, Kangawa K, Mochizuki N. Cyclic AMP potentiates VE-cadherin-mediated cell-cell contact to enhance endothelial barrier function through Epac-Rap1 siganaling pathway. Mol. Cell Biol. 25: 136-146, 2005



