猪子 誠人・稲垣 昌樹 愛知県がんセンター発がん制御研究部
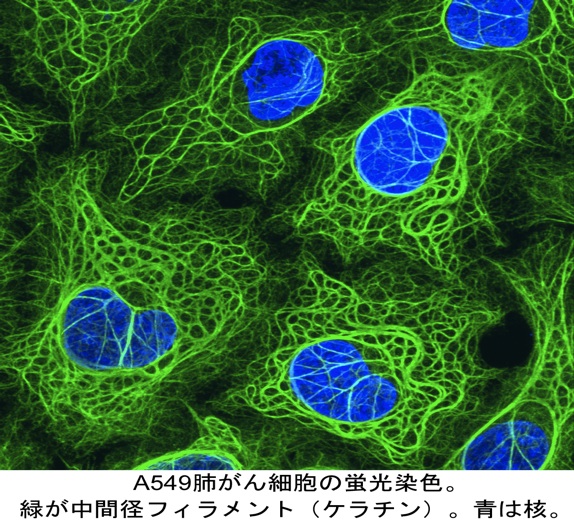
中間径フィラメント(fig1)は、アクチン繊維、微小管とならび細胞骨格を構成する主要3繊維の一つである。その名は、筋組織の電子顕微鏡観察においてミオシンIIの太いフィラメントとアクチンの細いフィラメントの中間の太さを示したことに由来するが(石川春律博士ら、文献1)、その太さ(10nm)はアクチン繊維と微小管の中間でもある。特徴として、これら3つの繊維の中では生化学的に最も溶けにくく、物理的には最も引っ張りに強い。そのため、細胞に機械的強度を付与していると考えられ、このことは変異動物や遺伝学の解析結果からも裏付けられている(教科書1, 2; 総説1; 以下同様)。 このような強い繊維構造は構成蛋白質同士が重合することによって構築される。その種類は複数あり、それぞれの相同性も互換性も低いが、構造的な類似によってフィラメント自体は同じサイズの似た性質となる。つまり、基本構造は長い棒状ドメイン(rod)とそれを挟む頭部(head)・尾部(tail)からなり、また重合に寄与する配列には保存性がある。 中間径フィラメントの種類についてみると、無脊椎動物にも類縁は存在するが少ない。一方、高等脊椎動物は中間径フィラメント構成蛋白質の種類が最も多く複雑である。それらは6つのグループに分けられ、重合できるグループは決まっている。さらにその発現に厳密な組織特異性が見られる。すなわち、ケラチン(keratin)は上皮細胞に、ビメンチン(vimentin)は結合組織細胞に、デスミン(desmin)は筋細胞に、GFAP (glial fibrillary acidic protein)はグリア細胞にそれぞれ発現する。 この特性は、医学領域においては腫瘍の分化マーカーとして利用されている。これを細胞生物学的に詳しく見れば、上皮の中間径フィラメントとしてのケラチンの特異性は高いが、そのサブタイプは20を超える。また、神経、筋、結合組織ではビメンチンをはじめ重なり合って発現する他の蛋白質がいくつかある。この冗長性が、中間径フィラメントの機能解析を困難にしている。 しかし近年の実験技術や遺伝子工学の進展により、各中間径フィラメントに特異的に結合する蛋白質が同定されるようになってきた。その中には、細胞種特異的な機能とよく相関を示すものがある(総説1, 2; 文献2, 3, 3′, 4, 4′; 中間径フィラメント結合蛋白質の項も参照)。このことから、中間径フィラメントはこれら結合蛋白質にとっての足場(scaffold)でもあり、高等脊椎動物にみられる細胞種特異的な発現は、それぞれの細胞特性の付与に貢献しているのではないかと考えられるようになり、新たな注目を集めている。
参考文献
文献1) Ishikawa H, Bischoff R, Holtzer H. J Cell Biol. 1968 Sep;38(3):538-55.
文献2) Kim S, Wong P, Coulombe PA. Nature. 2006 May 18;441(7091):362-5.
文献3) Sugimoto M, Inoko A, et al. J Cell Biol. 2008 Oct 6;183(1):19-28.
文献3′) “Research Highlight” Nat Rev Mol Cell Biol. 2008 Nov;9:825
文献4) Inoko A, Matsuyama M, et al. J Cell Biol. 2012 Apr 30;197(3):391-405.
文献4′) “In Focus: Trichoplein keeps primary cilia silent” J Cell Biol. 2012 Apr 30;197(3):341.
教科書1) 細胞の分子生物学 第5版 第16章 細胞骨格, NEWTON PRESS
教科書2) ルーイン細胞生物学 第4部 細胞骨格 9 中間径フィラメント, 東京化学同人
総説1) Fuchs E, Cleveland DW. Science. 1998 Jan 23;279(5350):514-9.
総説2) Coulombe PA, Wong P. Nat Cell Biol. 2004 Aug;6(8):699-706.



