猪子 誠人・稲垣 昌樹 愛知県がんセンター発がん制御研究部
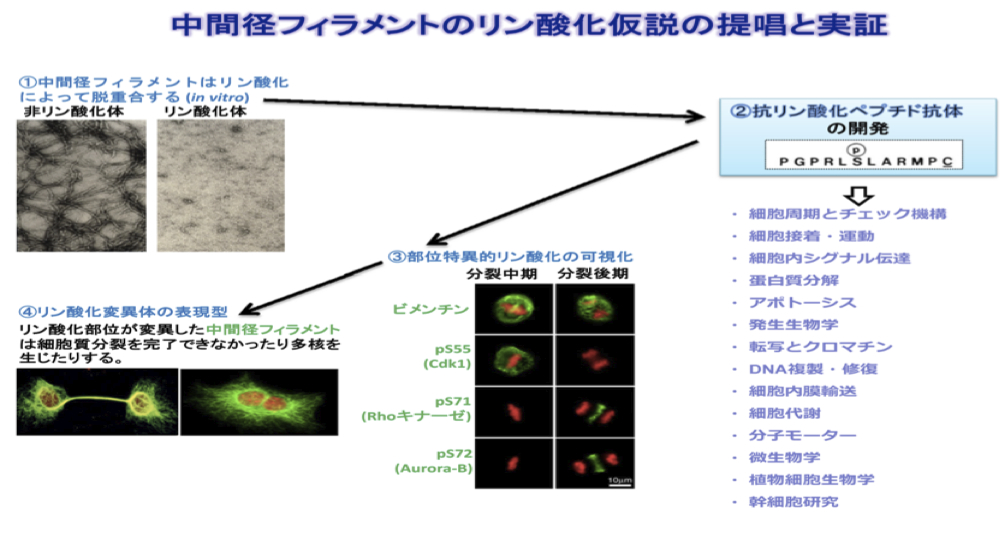
中間径フィラメント(中間径繊維と同義)はリン酸化により脱重合する。つまり、アクチン繊維や微小管と違い、基本的に濃度に依らない構築制御を受ける。そもそも中間径フィラメントは、非常に安定な不溶性の静的構造物と見なされていたため(中間径フィラメントの項を参照)、構築制御機構についての分子レベルでの理解は遅れていた。しかし1987年、稲垣昌樹博士ら(リンク1, 2)の報告により、中間径フィラメントの繊維構造がキナーゼによるリン酸化を受けて脱重合することがin vitroのビメンチン(vimentin)を用いた実験により明らかになった(fig1(1), 文献1)。この発見は、中間径フィラメントを動的な構造物として捉えなおす転機となり、従来の概念を変えたとされる。 この脱重合は細胞内現象として確認される必要があったため、アミノ酸残基のリン酸化を部位特異的に認識する抗体すなわち「抗リン酸化ペプチド抗体 (site- and phosphorylation state-specific antibody)」が同グループにより開発され、その作成から応用までが方法論として確立された(fig1(2), プロトコール1-3)。これらを用いた免疫染色により、ビメンチンが細胞分裂時に受ける複数の部位特異的リン酸化が可視化され、またそれぞれに特異的なキナーゼ(Cdk1, Rho-kinase, Aurora-B)が同定された(fig1(3); 総説1, 2)。さらにこのリン酸化部位を欠陥変異で置き換えると細胞質分裂が完了できなくなることを確認し(fig1(4))、このリン酸化による構築制御仮説は細胞現象、特に細胞分裂との関わりで実証された。 今、この方法論は細胞周期制御における重要なキナーゼカスケードの同定にも貢献している(fig1(2), 総説3)。 今後、このようなリン酸化変異体の影響を個体レベルで検討することが期待され、その研究は新展開を見せつつある。
参考文献
リンク1) 愛知県がんセンター研究所・発がん制御研究部(稲垣昌樹研究室)
リンク2) 名古屋大学グローバルCOEプログラム
文献1) Inagaki M, Nishi Y, Nishizawa K, Matsuyama M, Sato C. Nature. 1987 Aug 13-19;328(6131):649-52.
総説1) Izawa I, Inagaki M. Cancer Sci. 2006 Mar;97(3):167-74.
総説2) 猪子誠人・後藤英仁, 中間径フィラメントの構築制御機構と細胞内機能, 細胞骨格と接着・蛋白質核酸酵素・2006年5月号増刊 (貝淵弘三・稲垣昌樹・佐邊壽孝・松崎文雄 編), 51, 551-558, 2006
総説3) 後藤英仁・稲垣昌樹, G2/M移行期におけるCDK1の活性化およびチェックポイント解除機構, 細胞周期フロンティア (佐方功幸・稲垣昌樹・岸本健雄 編),52-57, 共立出版, 2010
プロトコール1) Goto H, Inagaki M. Nat Protoc. 2007;2(10):2574-81.
プロトコール2) 大海忍・辻村邦夫・稲垣昌樹 著, 抗ペプチド抗体実験プロトコール 新版, 秀潤社, 2004
プロトコール3) 後藤英仁・稲垣昌樹, Close Up実験法, 実験医学, 26, 2965-2972, 2008



