田村 淳・月田 早智子大阪大学大学院生命機能研究科
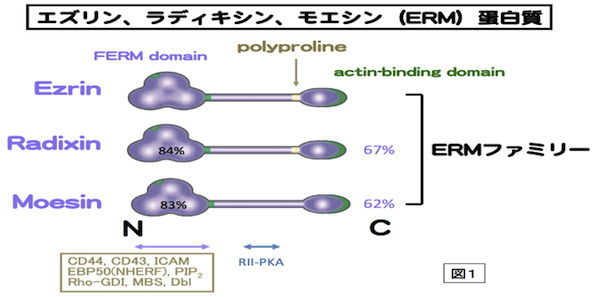
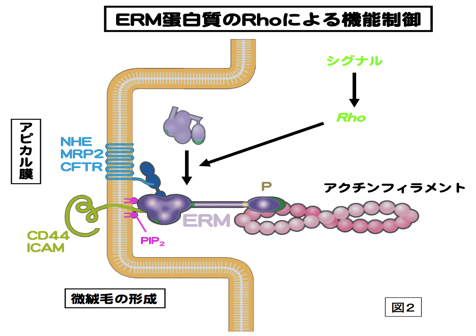
細胞骨格の1つであるアクチンフィラメントと細胞膜との動的な相互作用をつかさどる蛋白質ファミリー。微絨毛や神経成長錐、細胞分裂時の収縮環などアクチンフィラメントが細胞膜に結合する部分に局在する。アミノ酸レベルで75%程度の相同性を持つ3つの蛋白質Ezrin,Moesin,RadixinによりERMファミリーが形成され、各々の構成蛋白質はERM蛋白質とよばれる。いずれもN末側からFERMドメイン、α-ヘリックス領域、アクチン結合モチーフの順に並ぶドメインを持つ、分子量75kDaほどの分子である(図1)。エズリンとラディキシンは、モエシンにはないポリプロリンモチーフを余分に持つ。ERM蛋白質は、細胞膜-アクチンフィラメントを架橋する棒状の活性型と球状の不活性型の2つのコンフォメーションをとる。ERM蛋白質はRhoの下流で、PIP2により活性化されて、細胞膜とアクチンフィラメントに、各々、N末のFERMドメインとC末で結合すると考えられる。活性化型ERM蛋白質はC末のトレオニン残基のリン酸化により、安定化される。細胞膜との結合では、CD44などの細胞膜蛋白質に直接結合する場合と、トランスポーターなどの細胞膜蛋白質にPDZドメインをもつEBP-50を介して結合する場合がある(図2)。各々のERM蛋白質は、培養細胞では共発現することが多く、同じ局在を示すことも多いが、生体組織レベルでは、組織の種類によって異なる発現と局在を示す。例えば、肝細胞ではRadixinの発現が多く、腸管上皮細胞ではEzrinが、血管内皮細胞ではMoesinが多く発現している。Radixin、Ezrinのノックアウトマウスでは各々肝臓および胃の上皮細胞において、MRP2やHK-ATPaseのアピカル細胞膜への局在不全のためにDubin-Johnson型の高ビリルビン血症や胃酸分泌障害になる。上皮細胞アピカル表層構築に重要な蛋白質として、注目されている。
参考文献
Tsukita, S., Yonemura, S. (1999)
Kikuchi, S., Hata, M., Fukumoto, K., Yamane, Y., Matsui, T., Tamura, A., Yonemura, S., Yamagishi, H., Keppler, D., Tsukita, S., Tsukita, S. (2002)
Fehon, RG., McClatchey, AI., Bretscher, A. (2010)
Arpin, M., Chirivino, D., Naba, A., Zwaenepoel, I. (2011)
Neisch, AL., Fehon, RG. (2011)



