岡田 康志理化学研究所 神戸研究所 生命システム研究センター(QBiC)

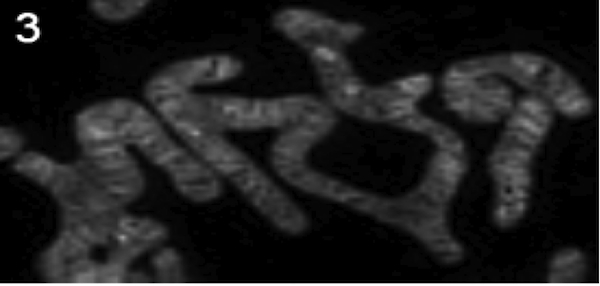
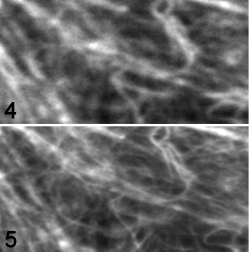
光が波としての性質(回折)を示すために、無限に小さな光源であっても、その光学顕微鏡像は波長の半分程度の大きさに滲んでしまう。可視光の場合、その大きさは200~300nmであり、これにより光学顕微鏡の分解能は規定される(回折限界 diffraction limit)。 近年、蛍光分子の特性を上手く活用することで回折限界を超える高い分解能を達成する技術が複数開発され、超解像顕微鏡法(super-resolution microscopy)と総称されている。現在よく知られている超解像顕微鏡法には、大きく分けて3つの種類がある。 1. 蛍光分子局在顕微鏡法(fluorescence localization microscopy) PALM/STORM/GSDIM (Photo Activation and Localization Microscopy, STochastic Optical Reconstruction Microscopy, Ground State Depletion and Individual Molecule return)と様々な名前が付けられているが、その基本的な原理は共通で、視野内の蛍光分子をランダムに個別に点滅させることで超解像を達成する。同時に点灯している蛍光分子の間隔が十分広ければ、各蛍光分子の位置の決定精度は画像のS/Nによって定まるので、回折限界以上の精度を達成することが出来る。これを多数回繰り返すことで視野内の蛍光分子すべての位置を決定し、その位置情報から画像を構築することで、超解像蛍光像が再構成される。そのため、分解能は、蛍光分子の位置決定精度で定まり、30 nm 以上の分解能が達成できる (fig1 画像1=通常蛍光像、画像2=PALM像 試料:微小管)。 この方法の発展型として、蛍光分子の明滅や消退による蛍光強度の揺らぎが蛍光分子を単位とする確率的な現象であることを利用して、蛍光強度の変動から超解像蛍光像を再構成する手法も開発されている(SOFI: Super-resolution Optical Fluctuation Imaging) 2. 構造化照明法(SIM: Structured Illumination Microscopy) SIMは、モアレ干渉を利用して特定方向の高分解能成分を取得する方法である。3方向×5位相の合計15枚の画像から再構成することで、x,y,zすべての方向で通常の蛍光顕微鏡の約2倍の分解能が達成できる。従って、例えばGFPなどの場合120 nm程度の分解能が期待できる。これは他の超解像手法顕微鏡法に比べると低い分解能であるが、蛍光色素の制約がないので、容易に多重標識の3次元超解像像を得られるのが特徴である。画像3(fig2)は、SIMによるミトコンドリア像。ミトコンドリアの内部構造を見ることが出来る。 3. 誘導放出制御法(STED: Stimulated Emission Depletion) STEDは、レーザー走査型コンフォーカル顕微鏡(CLSM: Confocal Laser Scanning Microscopy)の発展型である。誘導放出を利用してレーザーで蛍光が励起される点の大きさを回折限界以下に絞り込むことで超解像を達成する。従って、通常のCLSMと同様の操作で高速超解像イメージングが出来る。分解能は誘導放出制御光強度の平方根で決まり、およそ約50~80nmである (fig3 画像4:通常CLSM像、画像5:STED像 試料:EYFP標識F-actin)。ただし、使用できる色素には、励起光、蛍光、誘導放出光の3つがそれぞれ異なる波長の条件を満たす必要があるため、多重染色は困難である。



