孟文 翔1・竹市 雅俊 21Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 2理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB)
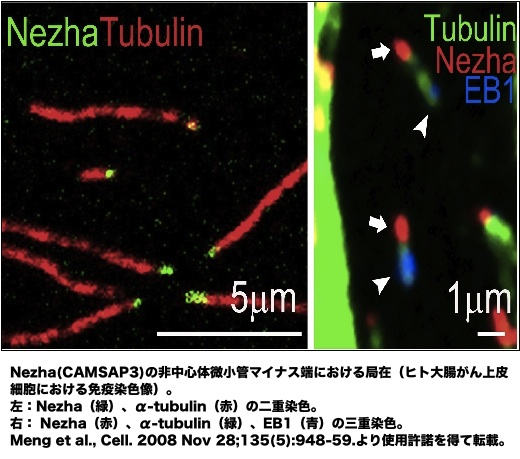
微小管は、プラス、マイナス両端において動的な構造体であるが、プラス端でチュ-ブリンの付加が起きやすい。この付加とマイナス端での解離がバランスされるとトレッドミル状態となることもあるが、マイナス端の脱重合速度はプラス端での重合速度よりも早いため、マイナス端が安定化されていなければ微小管は消滅する。しかし、マイナス端が何らかの形で安定化されると、微小管はブラス端だけで重合・脱重合を繰り返す[1, 2]。これが通常、細胞内でみられる微小管の状態である。 マイナス端の安定化は、中心体、またはそれ以外の細胞内構造(または分子)との結合によってもたらされ、それに対応して、微小管は中心体微小管、非中心体微小管とに分類される[2]。中心体では、γチューブリンがγ-チューブリン複合体蛋白質(γ-tubulin complex components, GCPs)と共にγチューブリン環複合体(γ-tubulin ring complex, γTuRC)を形成する。γTuRCは微小管マイナス端をキャップして安定化することで、プラス端における持続的な伸長/短縮ダイナミクスの繰り返しを可能とする。中心体は、さらに多数の成分を含み、微小管形成中心(microtubule organizing center, MTOC)としての役割を果たす[3-6]。哺乳類の細胞では、ninein、CEP192、CG-NAPとpericentrin などがγTuRCの機能を支え、これらの分子が欠損すると微小管の伸長が障害される[7-10]。 非中心体微小管は 上皮細胞、筋繊維、神経軸索等において顕著で、また、高等植物細胞はそもそも中心体を持たない。ゴルジ体、核膜、細胞膜等の構造体から非中心体微小管のプラス端重合が始まることが知られているが、その詳細な分子機構については未解明な部分が多い(繊毛微小管は、中心小体から成る基底小体から発するので、中心体微小管の一様式とみなすべきであろう)[2]。最近、微小管マイナス端結合因子Nezha(CAMSAP3)が同定され、非中心体微小管形成機構研究は新しい局面を迎えている。Nezhaは、接着結合(adherens junction, AJ)、及び、細胞質に分布し、微小管のマイナス端に結合してプラス端側の自由な伸長を支える(画像)。細胞接着部位では、Eカドヘリン-p120カテニン- PLEKHA7複合体にNezhaが結合することで微小管をAJにつなぎとめ、Nezha欠失によりAJが障害される[11, 12]。ショウジョウバエにはNezha 類似分子 Partronin(SSP4)があり、これが欠失すると細胞分裂時の紡錘体が縮小する。Partroninはマイナス端に結合することにより、キネシン13による微小管脱重合を阻害する[13, 14]。これは、Nezha/Patroninによる非中心体微小管の安定化機構をよく説明している。 またデスモソームにおいては、構成成分デスモプラキンに中心体から遊離したnineinが結合し、これが微小管をデスモソームにつなぎとめるという報告もあり、微小管マイナス端結合タンパク質が必要に応じて多様な細胞内構造に再配置される例が見つかってきている[15]。
参考文献
1. Kollman, J.M., Merdes, A., Mourey, L., and Agard, D.A. Nature reviews Molecular cell biology 12:709-721 (2011)
2. Keating, T.J., and Borisy, G.G. Biol Cell 91:321-329 (1999)
3. Kollman, J.M., Polka, J.K., Zelter, A., Davis, T.N., and Agard, D.A. Nature 466:879-882 (2010)
4. Wiese, C., and Zheng, Y. Curr Opin Struct Biol 9:250-259 (1999)
5. Wiese, C., and Zheng, Y. Nat Cell Biol 2:358-364 (2000)
6. Murphy, S.M., Preble, A.M., Patel, U.K., O’Connell, K.L., Dias, D.P., Moritz, M., Agard, D., Stults, J.T., and Stearns, T. Mol Biol Cell 12:3340-3352 (2001)
7. Delgehyr, N., Sillibourne, J., and Bornens, M. J Cell Sci 118:1565-1575 (2005)
8. Gomez-Ferreria, M.A., Rath, U., Buster, D.W., Chanda, S.K., Caldwell, J.S., Rines, D.R., and Sharp, D.J. Curr Biol 17:1960-1966 (2007)
9. Takahashi, M., Yamagiwa, A., Nishimura, T., Mukai, H., and Ono, Y. Mol Biol Cell 13:3235-3245 (2002)
10. Zimmerman, W.C., Sillibourne, J., Rosa, J., and Doxsey, S.J. Mol Biol Cell 15:3642-3657 (2004)
11. Meng, W., Mushika, Y., Ichii, T., and Takeichi, M. Cell 135:948-959 (2008)
12. Akhmanova, A., and Yap, A.S. Cell 135:791-793 (2008)
13. Goodwin, S.S., and Vale, R.D. Cell 143:263-274 (2010)
14. Gardner, M.K., Zanic, M., Gell, C., Bormuth, V., and Howard. Cell 147:1092-1103 (2011)
15. Lechler, T., and Fuchs, E. J Cell Biol 176:147-154 (2007)



