山城 佐和子・渡邊 直樹東北大学 大学院生命科学研究科
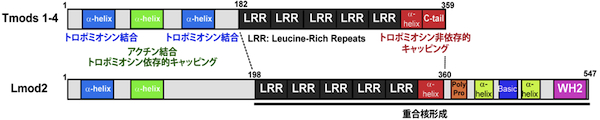
アクチン線維マイナス端 (矢じり端 または pointed end) キャッピングタンパク質。マイナス端に弱く結合する(解離定数= 約 0.1 μM)が、 アクチン結合タンパク質トロポミオシンにも結合し、トロポミオシンが結合したアクチン線維に対して強いキャッピング活性を示す(解離定数=約 0.2 nM)。海綿以後の多細胞生物で普遍的に存在し、酵母と植物では相同遺伝子は同定されていない。ほとんどの脊椎動物は4つの分子種(Tmod1-4) を持つ。生体内では、マイナス端キャッピング活性によりアクチン線維の安定性と長さを調節すると推測されており、心筋・骨格筋の筋原繊維形成、及び、赤血球・上皮細胞・レンズ繊維細胞のスペクトリン細胞膜骨格の形成と維持に関与する。ショウジョウバエ飛翔筋の筋原繊維と赤血球のスペクトリン細胞膜骨格では、アクチン繊維の長さ調節に関与する。培養細胞の細胞運動では、Tmod3 がラメリポディアに局在し、アクチン線維のダイナミックな再編成の調節に関与する。脊椎動物では、類縁のアクチン結合タンパク質にライオモディン (leiomodin, Lmod1-3) があり、N末端側のトロポモジュリン相同ドメインと、C末端側の アクチン結合WH2モチーフを含むドメインからなる (画像参照)。ライオモディンは強いアクチン重合核形成活性を持ち、この活性にはトロポモジュリン相同ドメインの一部 (leucine-rich repeats) とC末端側のドメインが必要である。横紋筋及び平滑筋に発現し、Lmod2 は筋原繊維形成に関与する。
参考文献
Yamashiro S, Gokhin DS, Kimura S, Nowak RB and Fowler VM, Tropomodulins: pointed-end capping proteins that regulate actin filament architecture in diverse cell types. Cytoskeleton in press
Gokhin DS and Fowler VM, Tropomodulin capping of actin filaments in striate muscle development and physiology. J Biomed Biotechnol. 2011; Epub 2011 Oct 17.



