清末 優子 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB)
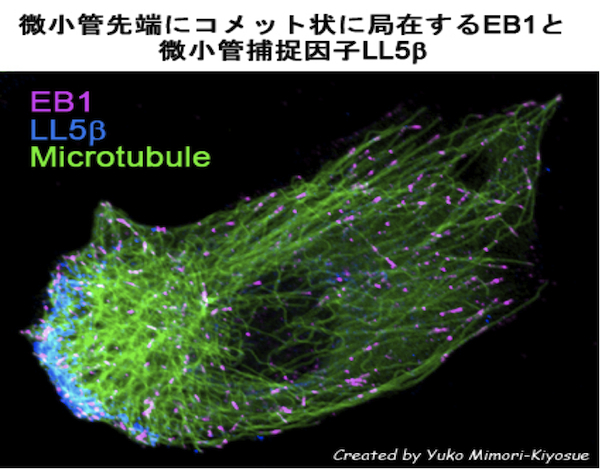
微小管細胞骨格は、種を超えて高度に保存された細胞の基盤構造体であるが、様々な制御因子によってそのダイナミクスや機能、配置が制御されることで、生命活動における多様なニーズに応じた役割を果たしている(「古典的MAPs」「微小管不安定化因子」「微小管切断因子」「微小管の重合核形成」「チューブリンの翻訳後修飾」の稿参照)。微小管を制御する因子の中で、微小管のプラス端に結合する分子群を、“微小管プラス端集積因子: Microtubule plus-end-tracking proteins (+TIPs)”と総称する。 Microtubule plus-end-tracking proteins (+TIPs)という命名は、GFP融合タンパク質のライブイメージングで観察された、伸長する微小管先端部にコメット状に集積して微小管伸長の軌跡をトラッキングするという、この分子群の特異な動態に由来する(「EB1ファミリー・タンパク質」の稿参照)。この種の分子の動態は最初、1999年に、GFP融合cytoplasmic linker protein (CLIP)-170の動画によって示された[1]。その後、2000年の筆者らのend-binding 1 (EB1) [2]、adenomatous polyposis coli (APC) 癌抑制因子[3]、2001年のAkhmanovaらのCLIP-associated proteins (CLASPs) [4]と、主要な逆行性モーター分子である細胞質ダイニン[5]、また同時期にこれらの分子の酵母ホモログが同様に微小管先端に結合することが相次いで明らかになったことから、2001年にPellmanのグループによって“+TIPs”の総称が提唱された[6]。+TIPsの和訳、“微小管プラス端集積因子”は、2002年に伊藤知彦氏(当時名古屋大学)によって最初に記載されたもので[7]、以降筆者はこの呼称を用いている。 その後、異なる機能を持つさらに多くの分子も+TIP様に挙動することが明らかにされてきた。これには、アクチン-微小管結合タンパク質ACF7 [8]、ERのCaセンサー膜タンパク質stromal interaction molecule 1 (STIM1) [9] 、チューブリン重合促進活性を有するXMAP215/TOGファミリー分子とEB1を結合させるSLAIN2 [10]やsentin [11]、微小管脱重合活性を持つモータータンパク質MCAK [12]なども含まれる。 これら+TIPsの中で唯一EB1のみ、精製タンパク質を用いたin vitro再構成実験系において微小管伸長端トラッキングが観察され、微小管構造の何らかの違いを認識して直接結合していることが証明されている[13, 14]。多くの+TIPsはそれ自体でも微小管結合能を有するが、そのほとんどがプラス端への集積はEB1との相互作用に依存しており、EB1が+TIP複合体形成のコアとなっている。XMAP215も微小管伸長端に直接作用するが、メカニズムはEB1とは異なる[15]。 +TIPsが集積すると、微小管の伸長/短縮のダイナミクスを制御するのみならず、プラス端を細胞内構造に結合させることでオルガネラをリンクさせたり微小管ネットワークの非対称性を生み出したりする。例えばSTIM1は微小管とERの相互作用を仲介し、細胞外からのシグナルを受けて細胞表層の一部に局在する因子CLASP/LL5、ACF7、APCは、微小管を局所で捕捉し安定化することで微小管を非対称に配置して細胞極性の形成と維持に寄与している(図)[16]。細胞分裂における分裂装置の形成と染色体分配にも関与している。このように+TIPsは、微小管の長さや配置を制御することで、生命活動の数々のプロセスの中で重要な役割を担っている。
参考文献
1. Perez, F., Diamantopoulos, G.S., Stalder, R. & Kreis, T.E. CLIP-170 highlights growing microtubule ends in vivo. Cell 96, 517-527 (1999).
2. Mimori-Kiyosue, Y., Shiina, N. & Tsukita, S. The dynamic behavior of the APC-binding protein EB1 on the distal ends of microtubules. Curr Biol 10, 865-868 (2000).
3. Mimori-Kiyosue, Y., Shiina, N. & Tsukita, S. Adenomatous polyposis coli (APC) protein moves along microtubules and concentrates at their growing ends in epithelial cells. J Cell Biol 148, 505-518 (2000).
4. Akhmanova, A. et al. Clasps are CLIP-115 and -170 associating proteins involved in the regional regulation of microtubule dynamics in motile fibroblasts. Cell 104, 923-935 (2001).
5. Han, G. et al. The Aspergillus cytoplasmic dynein heavy chain and NUDF localize to microtubule ends and affect microtubule dynamics. Curr Biol 11, 719-724 (2001).
6. Schuyler, S.C. & Pellman, D. Microtubule “plus-end-tracking proteins”: The end is just the beginning. Cell 105, 421-424 (2001).
7. 伊藤知彦, 微小管, 「細胞骨格と細胞運動」竹縄忠臣・編,シュプリンガー・フェアラーク東京, 24-34 (2002).
8. Kodama, A., Karakesisoglou, L., Wong, E., Vaezi, A. & Fuchs, E. ACF7: An essential integrator of microtubule dynamics. Cell 115, 343-354 (2003).
9. Grigoriev, I. et al. STIM1 is a MT-plus-end-tracking protein involved in remodeling of the ER. Curr Biol 18, 177-182 (2008).
10. van der Vaart, B. et al. SLAIN2 links microtubule plus end-tracking proteins and controls microtubule growth in interphase. J Cell Biol 193, 1083-1099 (2011).
11. Li, W. et al. EB1 promotes microtubule dynamics by recruiting Sentin in Drosophila cells. J Cell Biol 193, 973-983 (2011).
12. Moore, A.T. et al. MCAK associates with the tips of polymerizing microtubules. J Cell Biol 169, 391-397 (2005).
13. Bieling, P. et al. Reconstitution of a microtubule plus-end tracking system in vitro. Nature 450, 1100-1105 (2007).
14. Maurer, S.P., Bieling, P., Cope, J., Hoenger, A. & Surrey, T. GTPgammaS microtubules mimic the growing microtubule end structure recognized by end-binding proteins (EBs). Proc Natl Acad Sci U S A 108, 3988-3993 (2011).
15. Brouhard, G.J. et al. XMAP215 is a processive microtubule polymerase. Cell 132, 79-88 (2008).
16. Mimori-Kiyosue, Y. Shaping microtubules into diverse patterns: Molecular connections for setting up both ends. Cytoskeleton (Hoboken) 68, 603-618 (2011).



