定家 和佳子、松田 道行、青木 一洋
京都大学大学院医学研究科 時空間情報イメージング拠点
概要・原理
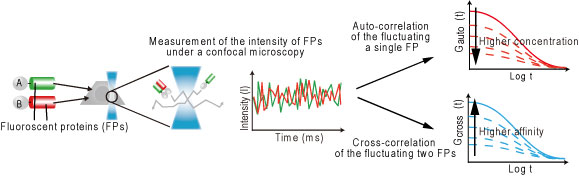
蛍光相互相関分光法(FCCS)を用いて生きた細胞のなかで解離定数(Kd)を定量する方法を紹介する。FCCSはレーザー光がつくる小さな領域の蛍光のゆらぎを測定することで蛍光タンパク質の濃度、複合体の濃度を算出する方法である。この方法は分子の固層化の必要がなく検出感度が高いことから、細胞内での相互作用解析に有用だと考えた。本プロトコルでは、タンパク質Aとタンパク質Bの相互作用を測定する場合を例にして説明する。
装置・器具・試薬
装置
共焦点顕微鏡 ⇒LSM780META/ConfoCor2 system (CarlZeiss)
器具
35mm ガラスボトムディッシュ
材料、試薬
1.以下の融合タンパク質を発現するベクター HaloTag-mEGFP, mEGFP, HaloTag, EGFP-A, HaloTag-B
2.HaloTag TMR ligand
3.DMEM-V培地 (Bogdanov et al., 2009)
詳細
- [細胞の準備]
- HeLa細胞を35mm ガラスボトムディッシュに播種
- 1日後、以下の組み合わせで融合タンパク質が発現するようにトランスフェクション
(1)ポジティブコントロール HaloTag-mEGFP
(2)ネガティブコントロール mEGFP、HaloTag
(3)測定したいタンパク質のペア mEGFP-A、HaloTag-B - 2-3日後、5μMのHaloTag TMR ligand 溶液 120μLをディッシュのガラス底部分に添加し、5% CO2、37℃で15分間インキュベート
- HaloTag TMR Ligand溶液を除いた後、PBS 2mlで2回洗浄し、DMEM-V培地を2ml加え5% CO2、37℃で15分間インキュベート
- DMEM-V培地2mlを加えて洗浄した後、再びDMEM-V培地を加える
- [FCCS測定]
- 測定条件 ・GFP 励起波長 488nm、取得波長 505-540nm ・TMR 励起波長 561nm、取得波長 615-680nm ・40倍水浸レンズ(C-Apochromat 40x/1.2W Corr M27)
- 細胞を観察し、目的とするタンパク質が発現している細胞を選択
- 1細胞につき7点、1点あたり4秒7回測定
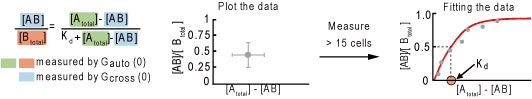
- ソフトウェア(Zen)により自己相関関数、相互相関関数のデータを取得 5.Excel あるいはMatLabにより解析(Fig.2)
工夫とコツ
・生データをよく見る。シグナルが十分か。ノイズを拾っていないか。ピントがずれていないか。測定中にIntensityが大きくなったり小さくなったりしていないか、目で確かめる。
・mEGFP-AとHaloTag-Bの発現量が近くなるよう、トランスフェクションするプラスミドの量を最適化する。例えばAの分子量>>Bの分子量の場合、mEGFP-AをHaloTag-Bよりも多くトランスフェクションする必要がある。
参考文献
Bogdanov, A.M., Bogdanova, E.A., Chudakov, D.M., Gorodnicheva, T.V., Lukyanov, S., and Lukyanov, K.A. (2009). Cell culture medium affects GFP photostability: a solution. Nat Methods 6, 859-860.
Sadaie, W., Harada, Y., Matsuda M., and Aoki, K., (2014). Quantitative in vivo Kd analyses highlight the importance of competitive effect in the regulation of protein-protein interactions. Mol Cell Bio, in press



