加藤 洋平, 中山 和久
京都大学薬学研究科生体情報制御学分野
概要・原理
一般的な抗体は重鎖と軽鎖からなる複合体であるが、ラクダ科の動物は例外的に重鎖のみでできた特殊な抗体を持っている。その重鎖抗体は可変領域のみで抗原と結合できることが知られており、この最小ドメインはNanobodyまたはVHHと呼ばれている。Nanobodyの抗原に対するアフィニティは普通の抗体と同等かそれ以上である(GFP-NanobodyのKd値は約1nM)。しかもNanobodyは約15kDaと小さいため、大腸菌を使って容易に作製することができる。ここではGSTタグを付加したGFP-Nanobodyの大腸菌での発現と精製の方法を紹介する。作製したGFP-Nanobodyは蛍光タンパク質を用いた免疫沈降法に利用することができる。(Ref.1)
装置・器具・試薬
pGEX6P1-GFP-Nanobody (Addgene #61838)
BL21(DE3)などのタンパク質発現用の大腸菌株
Glutathione Sepharose 4B beads (GE healthcare)
LB培地
LBプレート(+Amp) IPTG Binding buffer: PBS(-), 5 mM DTT, Protease inhibitors Wash buffer: PBS(-), 5 mM DTT, 0.1% Triton X-100
遠心機
振盪培養器
詳細
- BL21などのタンパク質発現用の大腸菌株にGFP-Nanobodyのプラスミドを導入し、LB +Amp plateにまいて37ºC、O/Nで培養する。
- コロニーをひろい、2-5 mL LBで前培養する。(6 h~O/N) (このときグリセロールストックを作っておくと次に作るときに便利。)
- 200 mL LBに培養後の大腸菌を2 mLを加えて、OD600=0.5になるまで37ºCで培養する。(OD600=0.4-1.0くらいならOK。だいたい2-4 hかかる。)
- IPTGを0.1 mMになるように加えて、20ºC、O/N(12~20 h)培養する。(30ºC, 4hでもOK)
- 培養液を遠心して集菌する。 6,000 rpm (5,550 g), 4℃, 15 min
- 10 mL Binding bufferでペレットを懸濁する。
- 大腸菌を超音波破砕する。(機械の出力によるが15 sec x 5回程度。一般的な大腸菌の破砕条件でOK)
- Triton X-100をfinal 1%になるように加えて、on iceで15-30 min静置する。
- 遠心して上清を回収する。12,000 rpm (20,700 g), 4℃, 20 min (すぐに精製しないときは上清を-80ºCで凍結保存しておくことも可能。)
- 上清とGlutathione Sepharose beadsを混ぜて、ローテーターで回転させながらビーズに結合させる。 4℃, 2 h-O/N
- ビーズをwash bufferで8回洗浄し、50 % slurryになるようにwash bufferを加えて4℃で保存する。
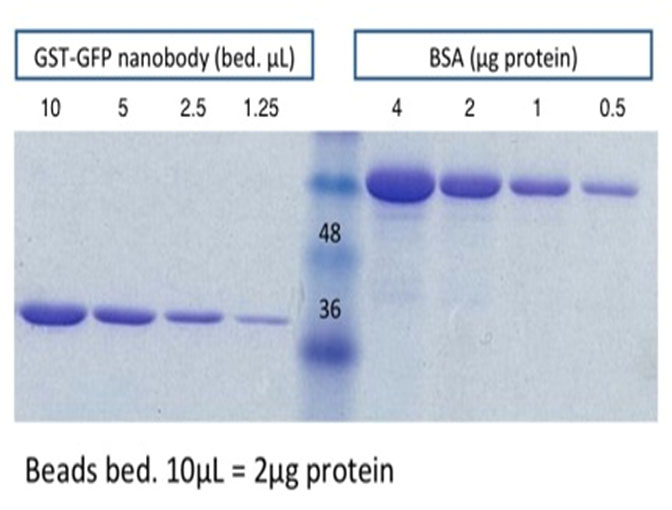
- GFP-Nanobody beadsにSample bufferを加え95ºCで10 minボイルする。その後SDS-PAGEし、CBB染色をして収量と精製度を確認する。GST-GFP-Nanobodyは約40 kDa。【fig.1】
工夫とコツ
GFP-Nanobody遺伝子はRef. 2のアミノ酸配列をもとに人工遺伝子合成によって作製した。作製したプラスミドはAddgeneに寄託済みだが、著者に連絡をいただければ直接分与することも可能。GST-GFP-Nanobodyを作るのは簡単でコストもほとんどかからないので自作がおすすめである。
200 mLの培養液から約1 mgのGST-GFP-Nanobodyが精製できる。 免疫沈降に使うときは約1 µg/10 µL(bed vol. 5 µL)になるようにタンパク量を調節している。
GFP-Nanobodyが結合する蛍光タンパク質の種類
結合する: EGFP, YFP, Venus
結合しない: mRFP, mCherry, TagRFP, TagBFPなど
EGFPの位置はN末でもC末でもNanobodyとの結合にはほとんど影響しない。
参考文献
1. Katoh, Y., Nozaki, S., Hartanto, D., Miyano, R., and Nakayama, K. (2015) Architectures of multisubunit complexes revealed by a visible immunoprecipitation assay using fluorescent fusion proteins. J. Cell Sci., 128, 2351-2362.
2. Kubala, M. H., Kovtun, O., Alexandrov, K., and Collins, B. M. (2010) Structural and thermodynamic analysis of the GFP:GFP-Nanobody complex. Protein Science 19, 2389–2401



