加藤 洋平、野崎 梢平、中山 和久
京都大学薬学研究科生体情報制御学分野
概要・原理
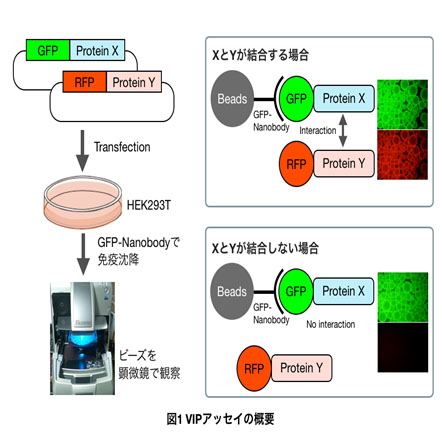
私たちは蛍光タンパク質とGFP-Nanobody(ラクダ科の単鎖抗体)を用いた共免疫沈降法に蛍光顕微鏡を組み合わせた、観るだけでわかるタンパク質間相互作用解析法(VIPアッセイ:Visible immunoprecipitation assay)を開発した【図1】(Ref.1)。VIPアッセイの原理は一般的な共免疫沈降法と同じであるが、手間のかかるウエスタンブロッティングをするのではなく、免疫沈降後のビーズに結合している蛍光タンパク質のシグナルを蛍光顕微鏡で直接検出することで、従来の免疫沈降法よりも簡単、迅速、安価にタンパク質間相互作用を調べることができる。ここではGFPとRFP融合タンパク質間の相互作用を調べるときの標準的なプロトコールを紹介する。
装置・器具・試薬
GFP融合遺伝子とRFP融合遺伝子のプラスミド
GFP-Nanobody beads(GFP-Nanobodyの作製法を参照) HEK293T細胞 培地: DMEM high glucose + 5% FBS Polyethylenimine (PEI) Max(Polyscience) Lysis buffer: 例. HNTG buffer(20 mM HEPES (pH7.5)、150 mM NaCl、0.1%(w/v)Triton X-100、10%(w/v)Glycerol、Protease inhibitors) 0.2 mL PCR tube strip (Greiner)
6 well plate
96 well plate
8連マルチチャネルピペット(20-200 µL)
蛍光顕微鏡 (GFPとRFPの蛍光を検出できるもの)
遠心機(eppen tubeとPCR tubeを回せるもの)
詳細
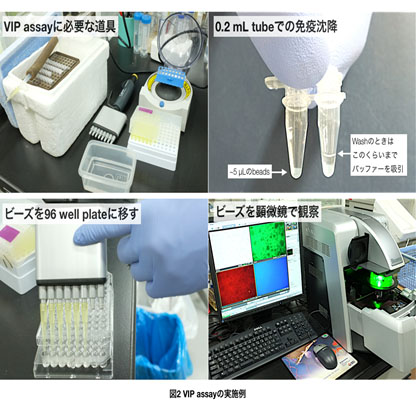
- HEK293T細胞を6 well plateに8.0 x 105 / wellでまいて24 h培養する。
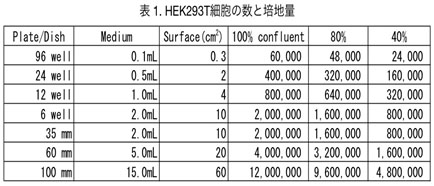
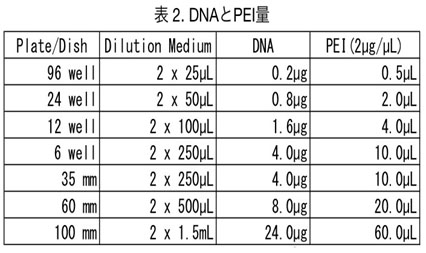
- Polyethylenimine (PEI)を用いてトランスフェクションする。(スケールアップ/ダウンする場合は【表1, 2】を参照。) 4 µg DNA (2µg GFP plasmid + 2µg RFP plasmid)/250 µL DMEM (血清を含まないもの) 20 µg PEI/250 µL DMEM (血清を含まないもの) , incubate, RT, ~5 min DNA sol. + PEI sol. Incubate, RT, 20 min 500 µL/ wellで加える。
- トランスフェクション24時間後にGFPとRFPの発現を蛍光顕微鏡でチェックし写真を撮っておく。
- 6 well plateから培地をよく取り除き、Lysis bufferを250 µL/well 加える。
- On ice ~5 min (細胞が自然と浮いてくるのでスクレーパーでかき取る必要はない。はがれていない細胞が残っているときはプレートを軽く揺すったり叩いたりすればはがれる。)
- 細胞をピペッティングで懸濁しつつ、エッペンチューブに移す。Incubate, on ice, ~15 min
- 遠心 13,200 rpm (16,100 g), 4℃, 15 min (この間に0.2 mL tube stripに5 μL(bed vol.)のGFP-Nanobody beadsを分注しておく。)
- 200 μLの上清をGFP-Nanobody beads入りのPCR tube stripに加える。
- ローテーションしながらビーズに結合させる。 4°C, 1 h (著者らの研究室ではローテーターに0.2 mL tube stripをビニールテープで貼り付けて回転させている。)
- Wash x 3回: 0.2 mL tube stripを10-30 sec遠心し、上清をアスピレーターで吸引する。180μLのLysis Bufferを加え、タッピングして懸濁する。
- 180μL の水またはPBSでビーズを懸濁して96 well plate に移す。
- 蛍光顕微鏡(20x/0.75NAの対物レンズを使用している)でビーズのGFPとRFPの蛍光を観察し写真を撮る。(蛍光強度を比較するため、露光時間などの条件は固定して撮影する。)
工夫とコツ
VIPアッセイのメリット: 簡単・迅速・安価
・ウエスタンブロッティングに必要な、アクリルアミドゲルの作製、電気泳動、メンブレンへのトランスファー、ブロッキング、一次抗体および二次抗体とのインキュベーション、メンブレンの洗浄、といった面倒な作業を一切せずにタンパク質間相互作用を調べられる。
・タンパク質間相互作用の有無と強弱を顕微鏡で見るだけで判定できるので直感的でわかりやすい。
・顕微鏡観察後に必要に応じてビーズを回収して、ウエスタンブロッティングをすることももちろん可能である。
・GFP-NanobodyとGFPのアフィニティは極めて高い(Kd=~1nM)ため免疫沈降を効率良く行うことができる。(HAタグ抗体やFLAGタグ抗体を使った場合と同等かそれ以上にうまく免疫沈降ができる。)
・紹介したプロトコールだと1アッセイにかかるコストは100円以下である。(普通の抗体を使って免疫沈降してWesternをすると数百円から千円以上かかる。)
・GFPやRFPという汎用性の高い蛍光タンパク質をタグとして利用するので、VIPアッセイのためだけにプラスミドを作る必要がない。蛍光タンパク質を付けたコンストラクトを作っておけば、VIPアッセイだけでなく、細胞内局在の観察などにも使えるので無駄になることがない。
スピードアップのための工夫
・Lysis前にPBS washをしない。Scrapeしない。Pre-clearしない。
以前はどの操作も行っていたが、してもしなくても結果は変わらないことがわかったので今は省略している。
・0.2 mL PCR tube stripを使う。 以前はeppen tubeを使っていたが、遠心機への出し入れが意外と面倒である。0.2 mL PCR tube stripを使えば、遠心機に8本まとめてセットして、数秒でビーズを沈降させることができる。Wash bufferを加えるときも8連ピペットを使えば一発である。観察用の96 well plateにビーズを移すときも同様に行う。
・Washのときバッファーをアスピレーターで吸引する。 以前はピペットマンを使って慎重にバッファーを取り除いて洗浄していたが、サンプル数が多いとかなり面倒な作業である。そこでアスピレーターでバッファーを吸引してみたところ、ビーズを吸ってしまうこともなく簡単に洗浄できるようになった。
・オールインワン型の顕微鏡を使う。 暗室に置いてある水銀ランプを光源とする蛍光顕微鏡よりも、オールインワン型の顕微鏡(Keyence BZシリーズなど)を使うとすぐに観察ができて便利である。
コスト削減のための工夫
・GFP-Nanobodyを自作する。 GFP-Nanobodyは大腸菌で作ることができるので、自分で作ればコストはほとんどかからない。(詳しくはGFP-Nanobodyの作製法を参照)
・FBSを5%で使う。 一般的には10%で使うことが多いが、HEK293Tを使ったVIPアッセイでは5%で何の問題もない。FBSは高価なので、半分に減らせるだけでかなりコスト削減できる。
・PEIを使ってトランスフェクションする。 Lipofection用の試薬は一般的に高価である。それに比べるとPEIは極めて安価である。(PEI 2gで2万円程度するが、一度買えば使い切れないほどの量になる。)しかも、PEIのトランスフェクション効率は市販のLipofection試薬と勝るとも劣らない(少なくともHEK293Tの場合は。)
・アッセイ系のスケールダウンをする。 著者らの研究室では6 well plateのスケールを標準としている。 PEIを用いたトランスフェクションの注意点 PEIにはやや細胞毒性がある。細胞密度が低いとPEIの影響で死にやすいので、トランスフェクション時の細胞密度は80-90%コンフルエントが良い。細胞が死んでしまう場合は、PEIの量を減らすか、培地の量を増やすと改善することがある。
参考文献
1. Katoh, Y., Nozaki, S., Hartanto, D., Miyano, R., and Nakayama, K. (2015) Architectures of multisubunit complexes revealed by a visible immunoprecipitation assay using fluorescent fusion proteins. J. Cell Sci., 128, 2351-2362.



