- ホーム
- >
- 細胞生物学用語集トップ
- >
- 細胞生物学用語集【E-H】
細胞生物学用語集【E-H】
【E】
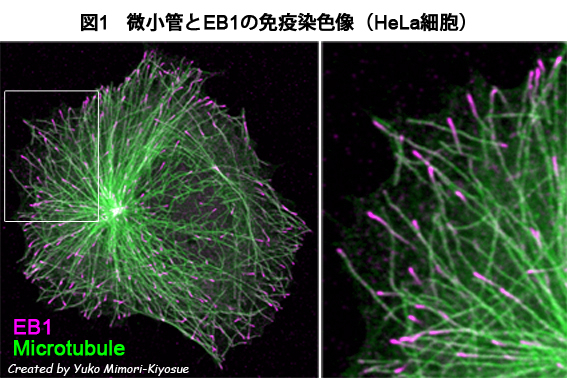
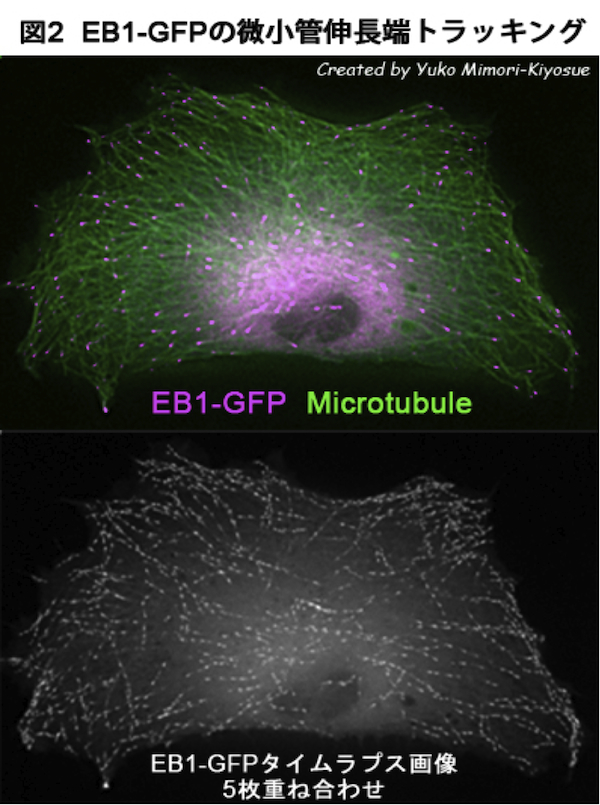
| EB1ファミリー・タンパク質 |
|---|
| 【EB1 family proteins】 |
| 清末 優子 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
| EGFRトランスアクチベーション |
|---|
| 【EGFR transactivation 】 |
| 目加田 英輔 |
| 大阪大学微生物病研究所細胞機能分野 |
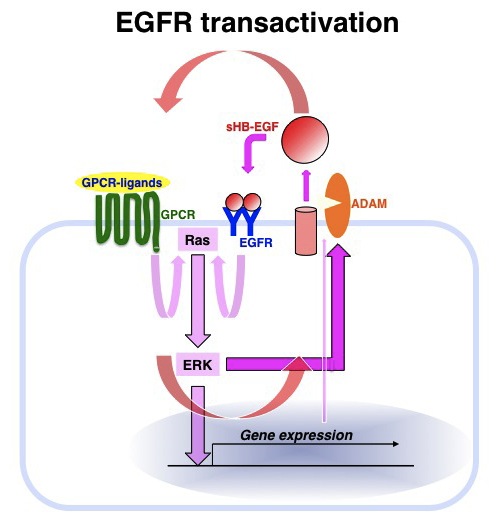
リゾフォスファチジン酸やエンドセリン、アンジオテンシンIIなどによるG蛋白共役型受容体(GPCR)の活性化に伴って、EGFRが活性化される現象をEGFRトランスアクチベーションと呼ぶ。この過程でHB-EGFのシェディングが中心的な役割を果たしていることが近年明らかになってきている。GPCRリガンドによるGPCRの活性化がRas-ERK経路を活性化し、このことがHB-EGFのシェディングを誘導し、分泌されたHB-EGFがEGFRを活性化し、さらにその下流でRas-ERK経路が活性化する。このことがさらなるHB-EGFのシェディングのみならずHB-EGF自身の発現をも誘導し、ここに細胞増殖あるいは移動促進などシグナルのポジティブ・フィードバックループが形成される。このようなEGFRトランスアクチベーション機構とこれによるポジティブループの形成が、心肥大や動脈硬化、高血圧、そして発癌など様々な病理にも深く関わっていることが近年わかってきている。参考文献蛋白質核酸酵素 54, 1722-1727, 2009 |
| EGFファミリー |
|---|
| 【EGF family 】 |
| 目加田 英輔 |
| 大阪大学微生物病研究所細胞機能分野 |
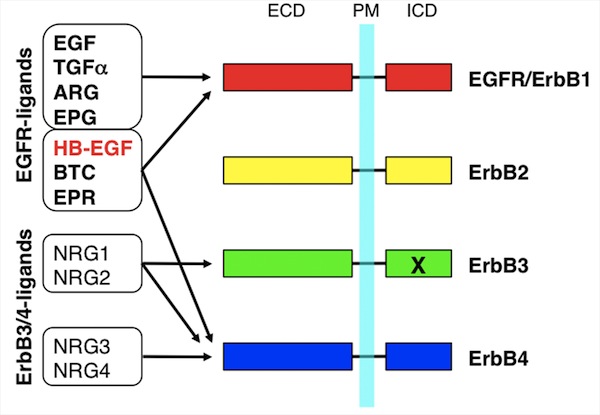
EGFファミリーの増殖因子はEGFRに結合する。一方、EGFRにもErbB2, ErbB3, ErbB4のファミリー分子が存在する。Neuregulin (NRG)はEGFRには結合せずErbB3, ErbB4に結合する。各ErbBはお互いにホモあるいはヘテロダイマーを形成して機能する。故に、例えばHB-EGFの場合、HB-EGFはEGFRとErbB4に結合するのでEGFRとErbB4を含む全てのホモあるいはヘテロダイマーを活性化しうる。このようなリガンド-受容体の対応関係が、受容体下流のシグナルの多様性を現すひとつの理由と考えられる。狭義にEGFファミリーという場合はEGFRに結合する増殖因子を指すことが多いが、広義にはNRG等ErbBファミリーに結合する増殖因子も含める。EGFファミリーの特徴として、これらの分子が膜型前駆体蛋白質として合成された後にエクトドメイン・シェディングと呼ばれる酵素的切断を受けて分泌されることがあげられる。参考文献Cytokine Growth Factor Rev. 11: 335-344. 2000 |
| ERMファミリー |
|---|
| 【ERM family】 |
| 田村 淳・月田 早智子 |
| 大阪大学大学院生命機能研究科 |
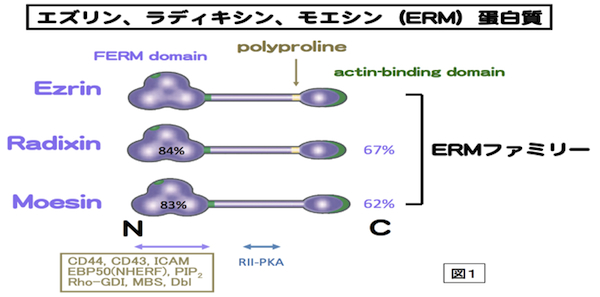
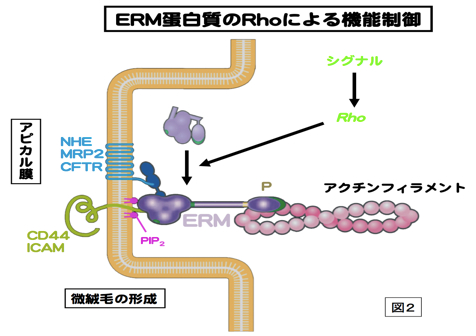
細胞骨格の1つであるアクチンフィラメントと細胞膜との動的な相互作用をつかさどる蛋白質ファミリー。微絨毛や神経成長錐、細胞分裂時の収縮環などアクチンフィラメントが細胞膜に結合する部分に局在する。アミノ酸レベルで75%程度の相同性を持つ3つの蛋白質Ezrin,Moesin,RadixinによりERMファミリーが形成され、各々の構成蛋白質はERM蛋白質とよばれる。いずれもN末側からFERMドメイン、α-ヘリックス領域、アクチン結合モチーフの順に並ぶドメインを持つ、分子量75kDaほどの分子である(図1)。エズリンとラディキシンは、モエシンにはないポリプロリンモチーフを余分に持つ。ERM蛋白質は、細胞膜-アクチンフィラメントを架橋する棒状の活性型と球状の不活性型の2つのコンフォメーションをとる。ERM蛋白質はRhoの下流で、PIP2により活性化されて、細胞膜とアクチンフィラメントに、各々、N末のFERMドメインとC末で結合すると考えられる。活性化型ERM蛋白質はC末のトレオニン残基のリン酸化により、安定化される。細胞膜との結合では、CD44などの細胞膜蛋白質に直接結合する場合と、トランスポーターなどの細胞膜蛋白質にPDZドメインをもつEBP-50を介して結合する場合がある(図2)。各々のERM蛋白質は、培養細胞では共発現することが多く、同じ局在を示すことも多いが、生体組織レベルでは、組織の種類によって異なる発現と局在を示す。例えば、肝細胞ではRadixinの発現が多く、腸管上皮細胞ではEzrinが、血管内皮細胞ではMoesinが多く発現している。Radixin、Ezrinのノックアウトマウスでは各々肝臓および胃の上皮細胞において、MRP2やHK-ATPaseのアピカル細胞膜への局在不全のためにDubin-Johnson型の高ビリルビン血症や胃酸分泌障害になる。上皮細胞アピカル表層構築に重要な蛋白質として、注目されている。参考文献 Tsukita, S., Yonemura, S. (1999)
Kikuchi, S., Hata, M., Fukumoto, K., Yamane, Y., Matsui, T., Tamura, A., Yonemura, S., Yamagishi, H., Keppler, D., Tsukita, S., Tsukita, S. (2002) Fehon, RG., McClatchey, AI., Bretscher, A. (2010) Arpin, M., Chirivino, D., Naba, A., Zwaenepoel, I. (2011) Neisch, AL., Fehon, RG. (2011) |
| M-Sec/TNFaip2/B94/EXOC3L3 |
|---|
| 【M-Sec/TNFaip2/B94/EXOC3L3】 |
| 大野 博司 |
| 理化学研究所・横浜研究所 免疫アレルギー科学総合研究センター(RCAI) |
| お問合せ |
正常ヒト臍帯静脈内皮細胞(HUVEC)をTNFα処理することによって発現上昇する遺伝子として始めに単離された、Sec6ファミリーに属する細胞質蛋白質。発生段階における造血系組織、精子の先体に高く発現する。低分子GTP結合蛋白質RalAとエキソシスト複合体と協調して、膜ナノチューブ形成に関わる。参考文献Nat. Cell. Biol. 11 (12), 1427-32, J. Biol. Chem. 269(5), 3633-40, |
| エクトドメイン・シェディング |
|---|
| 【Ectodomain shedding 】 |
| 目加田 英輔 |
| 大阪大学微生物病研究所細胞機能分野 |
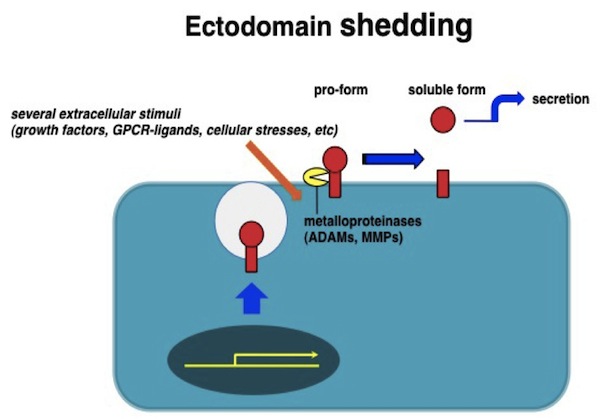
細胞増殖因子やサイトカイン、またこれらに対する受容体、あるいは細胞接着因子や細胞外マトリックスなど様々な細胞間情報伝達を担う分子群のある種のものは、細胞外からの刺激に伴って酵素的な切断を受け、細胞外に放出されることが古くから知られている。このプロセスはエクトドメイン・シェディングと呼ばれ、膜蛋白質を細胞膜にアンカーされた状態から細胞外に遊離させることで、分子の存在状態を劇的に変化させる。EGFファミリーの増殖因子をはじめとするある種の増殖因子やサイトカインは、はじめ膜結合型の前駆体蛋白として合成された後、シェディングによって細胞外に分泌される。エクトドメインシェディングは、特に膜結合型として合成される増殖因子やサイトカインにおいて情報の発信を制御する重要な機構のひとつである。種々のHB-EGF変異マウスの解析から、マウス生体内においてHB-EGFが正常にその機能を発揮するために、エクトドメインシェディングが非常に重要なステップであることが明らかになっている。 参考文献蛋白質核酸酵素 54, 1722-1727, 2009 |
| 小胞体ストレス応答 |
|---|
| 【ER stress response / Unfolded protein response】 |
| 吉田 秀郎 |
| 兵庫県立大学大学院生命理学研究科生体物質化学II講座 |
| 小胞体ストレス応答は、小胞体に立体構造が異常なタンパク質が蓄積した時(小胞体ストレス)に活性化される生体防御機構である。小胞体の重要な機能は、膜タンパク質や分泌タンパク質の立体構造形成である。分化などによって分泌タンパク質の産生量が増加すると、小胞体シャペロンによる分泌タンパク質のフォールディングが間に合わなくなり、小胞体内にフォールディングが未完成の分泌タンパク質が蓄積する。このような構造異常タンパク質の蓄積(小胞体ストレス)は細胞死を引き起こし、アルツハイマー病やパーキンソン病、糖尿病などのフォールディング病を引き起こす。細胞は小胞体ストレス応答を活性化することによって、小胞体ストレスに対抗し、細胞死から身を守ろうとする。
哺乳類の小胞体ストレス応答は3つの応答経路から成っている。ATF6経路は、小胞体シャペロンの発現を制御する経路である。小胞体膜上に存在するセンサー分子pATF6(P)が小胞体ストレスを感知すると小胞輸送によってゴルジ体へ運ばれ、ゴルジ体に存在するプロテアーゼS1PとS2Pによって切断される。その結果、細胞質側の転写因子部分pATF6(N)が膜から遊離して核へ移行し、転写制御配列ERSEに結合して小胞体シャペロン遺伝子の転写を誘導する。 IRE1経路は、小胞体に蓄積した構造異常タンパク質を分解処理するERAD(ER-associated degradation)関連因子の発現を制御する経路である。IRE1経路のセンサー分子であるIRE1は小胞体膜上に存在し、小胞体ストレスを感知するとオリゴマー化して活性化し、XBP1の前駆体mRNAを新規のmRNAスプライシング機構である細胞質スプライシングによって成熟型mRNAに変換する。成熟型mRNAからは活性型転写因子pXBP1(S)が翻訳され、pATF6(N)とともに転写制御配列UPREに結合することでERAD因子遺伝子の転写を誘導する。XBP1の前駆体mRNAからもタンパク質pXBP1(U)が翻訳されており、不要になったpXBP1(S)に結合してその分解を促進したり、XBP1 mRNAの翻訳速度を低下させるとともに小胞体膜に結合することによってXBP1の前駆体mRNAを小胞体に繋留する機能を持つ。 PERK経路のセンサー分子であるPERKも小胞体膜上に存在しており、IRE1と同様に小胞体ストレスを感知するとオリゴマー化して活性化する。PEKRは細胞質部分にキナーゼ領域を有しており、小胞体ストレス時には翻訳開始因子であるeIF2のalphaサブユニットをリン酸化することによって翻訳を一時的に抑制し、小胞体内腔での異常タンパク質の蓄積を抑制している。また、PERK経路は転写因子ATF4の翻訳を誘導し、転写制御配列AAREを介して翻訳関連因子や抗酸化因子の転写を誘導する。またATF4は転写因子CHOPの転写誘導を介してアポトーシスの誘導にも関わっている。 参考文献Mol. Biol. Cell (2010) 21, 1435-1438
Curr. Opin. Cell Biol. (2011) 23, 135-142 Science (2011) 334, 1081-1086 |
| 上皮細胞 |
|---|
| 【Epithelial cells】 |
| 鈴木 厚 |
| 横浜市立大学大学院医学研究科 |
| お問合せ |
| 上皮細胞は多細胞生物の内的環境を外界から遮断する細胞層を形成する細胞である。体表面を覆う「表皮」、および臓器の管腔表面を構成する「粘膜」、血管等の内腔を覆う「内皮」などを構成する細胞の総称であり、成体の約50%の細胞に該当する。生体の内部環境を維持する上で重要な役割を果たすとともに、受精卵から多細胞生物が発生する際のダイナミックな形づくり(形態形成)の過程においても、重要な動的役割を果たす。 容易に類推できるように、上皮細胞が機能する上では、細胞間の接着が非常に重要である。その接着構造は、十分に機械的強度を有する細胞間接着を示す必要がある一方で、細胞間を通じた選択的な物質の透過性を示す必要もある。これらの要請を満たすために、「密着結合 tight junction」, 「接着帯 zonula adherens」, 「デスモゾーム desomosome」という(最初は電子顕微鏡によって形態学的に観察された)特有な接着構造を発達させている。特に、最初の2種の接着構造は細胞周囲を一周、連続してベルト様に形成されるのが大きな特徴である。そして、これらの構造が細胞内の細胞骨格系(特にアクチン骨格系、中間径線維系)と密接に結びついている(微小管との関連の解明は現在に至る研究課題である)。 上皮細胞が機能する上では、外界に接する細胞膜と内部環境に接する細胞膜の間で非対称性(上皮細胞極性)を発達させることも非常に重要であり、その発達機構は、上記細胞間接着構造とも非常に密接に関わっている。 上皮細胞の増殖と運動は細胞間の接着に大きく制御されており、接着の破綻(たとえばE-cadherinの発現低下)は上皮―間葉変換(epithelia-mesenchmal transition)に結びつき、発癌に結びつく大きな原因となる。実際に、ほとんどの癌は上皮性である。 上皮性(上皮極性)と幹細胞性との関係も、近年の研究において、大きく注目されている。 参考文献 |
【F】
| FCMR/FAIM3/TOSO |
|---|
| 【FCMR/FAIM3/TOSO 】 |
| 大野 博司 |
| 理化学研究所・横浜研究所 免疫アレルギー科学総合研究センター(RCAI) |
| お問合せ |
FCMR/FAIM3/TOSOはFas仲介型のアポトーシスを阻害する因子として発見された分子である。その後、他のFc受容体とのアミノ酸配列の相同性から、IgMと結合する受容体として同定された(1)。PreB細胞以降のB細胞の成熟過程で発現していること(参考文献1, 図1)や、慢性リンパ球性白血病での発現量の増加(参考文献2)その発現がB細胞のシグナリングによって調節されていること(参考文献3)などから、B細胞の活性化や、シグナリングに影響を与えていることが予測される。参考文献(1)Shima, et al. Int. Immunol. (2010)
(2)Proto-Siqueira, et al. Blood (2008) (3) Pallasch, et al. Blood (2008) 抗体 |
| スペックル顕微鏡 |
|---|
| 【Fluorescent Speckle Microscopy】 |
| 渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
Waterman-StorerとSalmonがみいだした細胞骨格動態の蛍光顕微鏡撮影法。1996年、彼らが蛍光標識チュブリンを細胞にマイクロインジェクションしていたところ、低濃度で標識された細胞では、微小管がまだら(speckled)にみえ、微小管の軸方向への移動が可視化されたことの発見に端を発する。光の回折限界である0.2-0.3 ミクロンの領域に2-8個の蛍光標識が存在する場合、その数の確率的ばらつきから蛍光の強弱が生ずるが、それを可視化できる高感度の冷却CCDカメラが普及したことが本法の発見につながった。当初は、蛍光標識体のフォトブリーチング法よりも長時間にわたり、より高い時空間解像度で、微小管やアクチンネットワークの細胞内移動速度や方向を可視化する方法として利用された。後に、更に低密度の標識体をもちいて、細胞内アクチンを1分子ごとに可視化する単分子スペックル顕微鏡に発展し、アクチン線維の重合・脱重合やその制御分子の細胞内動態の可視化解析に用いられた。また、密度の高い標識の動態をコンピューター解析することで、細胞骨格分子や細胞接着分子の動態の全体像を迅速にとらえるqFSM法(quantitative Fluorescent Speckle Microscopy)がDanuserらによって開発された。(qFSM法については、結果に部分的にエラーが含まれる可能性も指摘されている。)参考文献 Salmon, E. D., Waterman, C. M. (2011) Mol. Biol. Cell. 22: 3940-3942.
Waterman-Storer, C. M., Salmon, E. D. (1997) J. Cell Biol. 139: 417-434. Watanabe, N., Mitchison, T. J. (2002) Science 295: 1083-1086. Danuser, G., Waterman-Storer. C. M. (2006) Annu. Rev. Biophys. Biomol. Struct. 35: 361-387. Vallotton, P., Small, J. V. (2009) J Cell Sci. 122: 1955-1998. |
| フィラミン |
|---|
| 【Filamin】 |
| 太田 安隆 |
| 北里大学理学部生物科学科 |
| お問合せ |
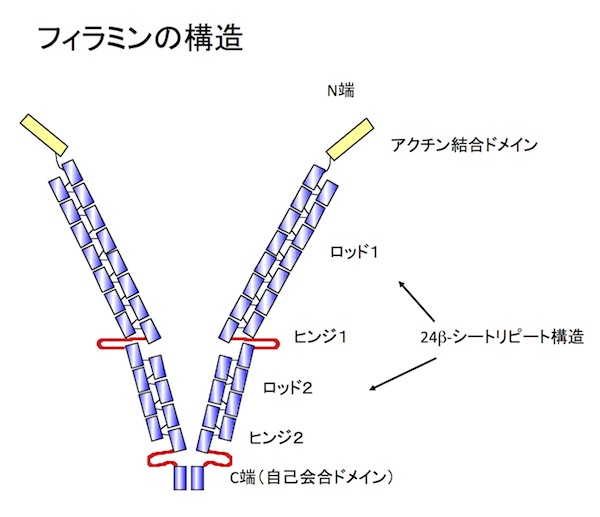
フィラミンは、アクチン繊維架橋タンパク質のひとつで、細胞皮層のアクチン繊維ネットワークの主要な構成分子の1つである。3種類のフィラミン(A, B, C)が知られている。このうちフィラミンAとBは各種臓器で発現してるが、フィラミンCは筋肉でのみ発現している。フィラミンは、分子量約280kDのサブユニットがC端で自己会合した2量体で、N端側のアクチン結合部位を使って、アクチン繊維を格子状に架橋してゲル構造を作ることができる(図1)。フィラミンAは、チャンネルタンパク質、受容体、タンパクキナーゼなど90種類以上の分子と結合し、シグナル伝達の足場タンパク質として機能している。血管内皮細胞の血流に対する応答や結合組織内を移動している白血球の運動など、細胞は様々な力学的な刺激に反応しながら生きている。フィラミンAは、細胞外からの力学的な力に応じてそのコンフォメーションを変化させ、インテグリンなどのフィラミン結合分子との相互作用を変化させることで力学的な刺激に対する細胞応答に関与することができる。フィラミン遺伝子の変異が複数の遺伝性疾患の原因であることがわかっている。例えばヒトにおいて、フィラミンの変異は脳室周囲異所性灰白室(フィラミンA)、家族制心臓弁膜ジストロフィー(フィラミンA)、boomerang dysplasia(骨異形成症)(フィラミンB)、筋原線維性ミオパチー(フィラミンC)を引き起こす。参考文献参考文献 Cell Adh Migr.5:160-9, 2011 (PMID: 21169733) |
| フィルギャップ |
|---|
| 【FilGAP】 |
| 太田 安隆 |
| 北里大学理学部生物科学科 |
| お問合せ |
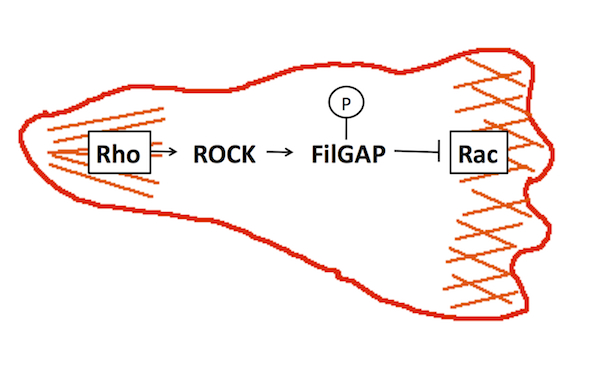
FilGAPは、低分子量GTP結合タンパク質 Racを特異的に不活化する因子GAP (GTPase-Activating Protein)の一つで、アクチン繊維架橋因子フィラミンに結合する。FilGAPを欠失した細胞は、細胞周囲に葉状仮足をランダムに進展させることからFilGPAは葉状仮足の形成制御に関与していると考えられる。FilGAPは、低分子量GTP結合タンパク質Rhoの標的タンパク質であるROCKキナーゼでリン酸化されると活性化される。細胞運動においては、Racが細胞の前部で活性化され葉状仮足を進展し、Rhoはミオシンを活性化し、収縮を促すことで細胞尾部を決定している。この細胞前部と尾部でのRacとRhoの特異的な活性化は、両者が互いに阻害し合っているからだと考えられており、FilGAPはRhoの下流でRacを不活化することで、RacとRhoの棲み分けに関与していると考えられる(図1)。FilGAPは、構造の似た他のRacGAPとファミリーを形成しており,メンバーとしてARHGAP22とARHGAP25が知られている。FilGAPの研究は北里大学理学部生体機能学講座のホームページに詳しく紹介されている。参考文献参考文献 Nat Cell Biol. 8:803-814, 2006 (PMID: 16862148) |
| フェルスター共鳴エネルギー移動 あるいは 蛍光共鳴エネルギー移動 |
|---|
| 【FRET (Förster Resonance Energy Transfer あるいはFluorescence Resonance Energy Transfer) 】 |
| 松田 道行 |
| 京都大学大学院生命科学研究科 生体制御学分野 |
| お問合せ |
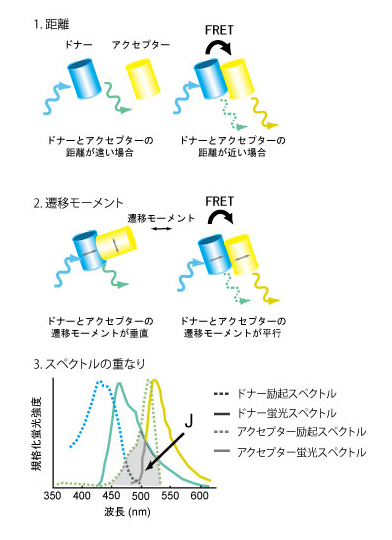
FRETとはこの現象の発見者の名前にちなんだFörster Resonance Energy Transferの略である。しかし、最近ではFluorescence Resonance Energy Transferの略と書いてある書籍が多く、蛍光共鳴エネルギー移動と邦訳されることが多い。FRETは、光子により励起されたドナー蛍光分子からごく近傍にあるアクセプター分子へエネルギーが共鳴移動する現象のことである。FRETの効率は、【1】蛍光発色団間の距離、【2】遷移モーメントの向き、【3】ドナー分子の蛍光波長域とアクセプター分子の吸光波長域の重なり、により主に規定される(1)。もっとも一般的なFRETの観察法はドナー蛍光の減少とアクセプター蛍光の増加を測定するが、厳密には、FRETはドナー分子の蛍光寿命を測定して定量される。FRETが蛍光タンパク質間でも観察されることを利用して、カルシウムを始めとするイオン、タンパク質リン酸化酵素、低分子量GTP結合タンパク質など、非常に多くの細胞内情報伝達分子に対するバイオセンサーが開発されている(2)。創薬においては、非常に長い蛍光寿命を持つユーロピウム(Eu)をドナーに用いることにより高いシグナルノイズ比のアッセー系が開発されている。参考文献 |
| フォルミンファミリータンパク質 |
|---|
| 【Formin homology proteins】 |
| 渡邊 直樹 |
| 東北大学 大学院生命科学研究科 |
| お問合せ |
フォルミンファミリータンパク質(以下、フォルミン)は、真核生物に広く存在するアクチン重合核形成促進因子である。哺乳類では〜15個、シロイヌナズナでは20余りの遺伝子が存在する。フォルミンの多くは、細胞質分裂、細胞極性形成に必須な遺伝子の産物である。マウスでは、Formin2の欠損で卵の減数分裂不全が、mDia1/3のダブルノックアウトで脳室下帯からの神経細胞の遊走の障害と、一部の個体において神経上皮の極性異常を伴った脳室周囲の異形成が生ずる。フォルミンは、C 末端側にフォルミン相同ドメイン1 と2(以下FH1,FH2)をもつ。FH1は、ポリプロリン配列の繰り返しからなり、FH2はフォルミンに特有のドメインで約400アミノ酸からなる。FH2はアクチン重合核形成作用をもつが、重合核形成後もアクチンの速い伸長端である反矢じり端(barbed end)にとどまり、連続的にアクチンを伸長させながら移動する、プロセッシブアクチン重合の性質をもつ。FH1は、複数のプロフィリン-アクチン複合体に結合することで、アクチン伸長を数倍に加速する。細胞内では、毎秒720個のアクチン単量体を取り込む速度で線維伸長することが、mDia1の細胞内分子可視化によって観察されている。参考文献 |
【G】
| ゴルジ体とトランスゴルジ網 |
|---|
| 【golgi body】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| ゴルジ体の構造は,一部の出芽酵母(たとえばSaccharomyces cerevisiae)のように,ゴルジ槽(Golgi cisternae)が層板構造をとらず細胞質中に散らばっているものから,植物や無脊椎動物のようにゴルジ槽が積み重なったゴルジ層板(Golgi stacks)が1つ1つ独立して存在するもの,哺乳動物のように巨大なゴルジリボン(Golgi ribbon)を形成するもの,と生物種によってさまざまである。しかし,その共通の特長として,入り口であるcis側から出口であるtrans側へ向けての機能的な勾配はよく保存されている。形態的に,cisとtransの端では,層板構造に連なる網状構造が見られることが古くから知られ,それぞれcis-Golgi network (CGN), trans-Golgi network (TGN)と呼ばれた。CGNは,ゴルジ層板近傍の中間区画(ERGIC)に相当すると考えると理解しやすい。一方TGN(日本語ではトランスゴルジ網と呼ぶ)については,ゴルジ体とは独立した別個の細胞小器官と考えた方がよいという考え方が浮上している。ゴルジ体の層板内を徐々に進行してきた積み荷タンパク質は,一旦TGNに到達した後,さまざまな目的地ごとに選別される。TGNがそこで果たす機能はきわめて多様であり,専門化した選別ステーションと考えるべきではないかというものである。驚くべきことに,TGNは植物では初期エンドソーム(early endosomes)としての機能ももつことが明らかになり,再循環エンドソーム(recycling endosomes)ときわめて近い役割をもつことも示されつつある。今後の研究の進展に目が離せない区画である。 |
| ゴルジ体ストレス応答 |
|---|
| 【Golgi stress response】 |
| 吉田 秀郎 |
| 兵庫県立大学大学院生命理学研究科生体物質化学II講座 |
ゴルジ体の機能が不足した際に、ゴルジ体の機能を強化し、ゴルジ体の恒常性を維持する機構。ゴルジ体ストレス時に転写制御配列GASE(Golgi apparatus stress response element コンセンサス配列はACGTGGC)を介して、ゴルジ体の構造形成因子や糖鎖修飾酵素、小胞輸送因子の遺伝子の転写が誘導されることがわかっているが、転写制御の詳細な機構は未知である。参考文献Cell Struct. Funct. (2011) 36, 1-12 |
【H】
| Heparin-binding EGF-like growth factor (HB-EGF) |
|---|
| 【Heparin-binding EGF-like growth factor (HB-EGF) 】 |
| 目加田 英輔 |
| 大阪大学微生物病研究所細胞機能分野 |
HB-EGFはEGFファミリーに属するヘパリン結合性の増殖因子である。この増殖因子は他のEGFファミリーと同様に、はじめ膜型蛋白質(proHB-EGF)として合成される。ProHB-EGFは細胞接着を介した細胞間情報伝達(ジャクスタクライン)に機能する一方、ジフテリア毒素受容体としても機能する。ProHB-EGFは細胞表面において種々の刺激に伴って酵素的切断を受け(エクトドメイン・シェディング)、その分泌型(sHB-EGF)が細胞外に放出される。sHB-EGFはEGF受容体(EGFR/ErbB1)あるいはErbB4に結合し、細胞増殖・運動など種々のシグナルを伝達する。シェディングに伴ってsHB-EGFとともに生成されるC末断片(HB-EGF-CTF)も細胞内へ移行して種々の遺伝子発現に関与する。HB-EGFノックアウトマウスなど種々の変異マウスの解析から、HB-EGFは心臓の発生や機能維持など様々な生理的過程、あるいは発癌などの様々な病理的過程で重要な働きをしていることが明らかとなっている。
参考文献UCSD-Nature Molecule Pages doi: 10.1038/mp.a002932.01, 2008 蛋白質核酸酵素 54, 1722-1727, 2009 |
| ヘミデスモソーム |
|---|
| 【Hemidesmosome】 |
| 藤原 佐知子 |
| 大阪大学大学院 基礎工学研究科 |
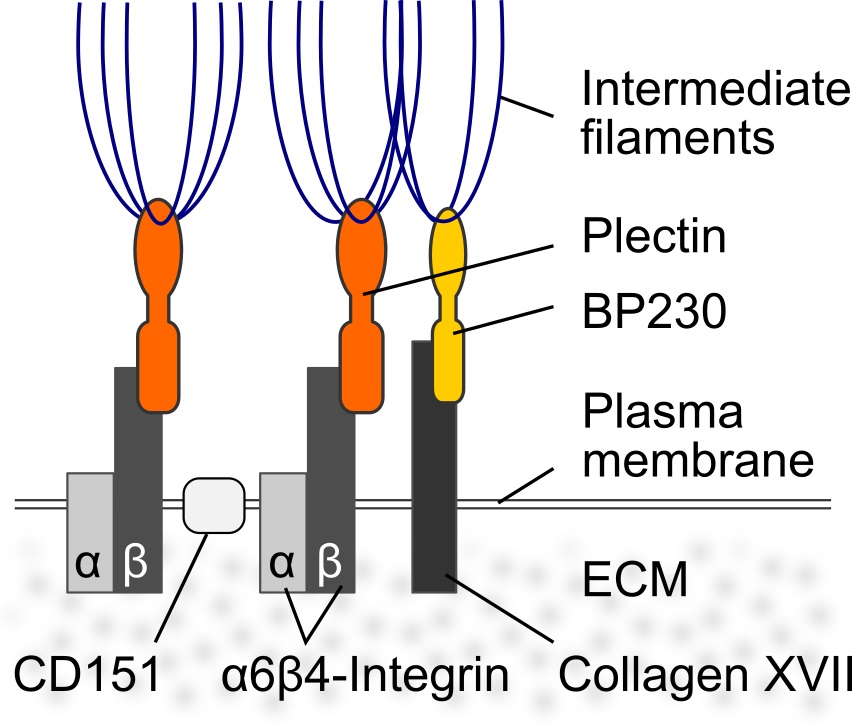
| ヘミデスモソームは上皮特異的な細胞-基質間接着複合体であり、上皮細胞を基底膜に連結する役割をもつ。ヘミデスモソームでは膜貫通タンパク質であるインテグリンα6β4が細胞外ドメインで細胞外基質と結合している。重層上皮では同じく膜貫通タンパク質であるコラーゲンXVIIも加わりヘミデスモソームが強化される。細胞内ではインテグリンβ4はプレクチンと、コラーゲンXVIIはBP230と結合し、これらがケラチン繊維を接着部位に繋留している(図1)。
ヘミデスモソームの構成タンパク質の機能不全は表皮水疱症などの重篤な皮膚疾患の原因となることから、上皮組織のバリア機能に重要であることが古くから知られている。加えて近年では、ヘミデスモソームが細胞運動やメカノセンシングに重要な役割をもつことを示唆する報告も増えている。ケラチノサイトでは、ケラチンを完全に失うとヘミデスモソーム構造が喪失し、基質への接着が早く、細胞運動の速度が早くなることが知られている。このことから、ヘミデスモソーム構造自体は中間径フィラメントに依存して形成されること、ヘミデスモソーム構造の減弱が細胞運動を促進することが示唆される。また、正常乳腺上皮細胞由来MCF10A細胞は三次元環境下で培養すると、基質が硬い環境では形質転換し間葉系細胞の性質を獲得することが知られている。このような基質の硬さ依存的な形質転換にはインテグリンα6β4のクラスター形成の抑制、ヘミデスモソーム形成の抑制と、それに伴うPI3K、Racシグナル経路の活性化が促進された結果、細胞運動能が亢進されることが示されている。上記の例からもヘミデスモソームがRhoシグナルを始めとする細胞内シグナル伝達経路の制御に関与し、細胞運動やメカノセンシング機能に寄与することは明らかである。しかしその詳細な分子機構については未だ不明な点も多く、今後の研究の進展が待たれる。 参考文献Chaudhuri O, Koshy ST, Branco da Cunha C et al. (2014) Nat Mater 13(10): 970-978.
Fujiwara S, & Mizuno K. (2017) eLS. John Wiley & Sons, Ltd: Chichester. DOI: 10.1002/9780470015902.a0026365. Osmani N, & Labouesse M. (2015) Curr Opin Cell Biol 32: 30-38. Seltmann K, Cheng F, Wiche G et al. (2015) J Invest Dermatol 135(6): 1609-1620. |
| 有毛細胞と難聴 |
|---|
| 【Hair cell and deafness 】 |
| 北尻 真一郎 |
| 京都大学医学部附属病院耳鼻咽喉科 |
| お問合せ |
| 音などによる振動を電気信号に変換し、神経へ伝える細胞を有毛細胞という。哺乳類、両生類、鳥類、魚類といった脊椎動物全般に加えて、昆虫類にも存在する。以下は哺乳類の音受容に関して述べる。
音は空気の振動であり、これは耳の穴(外耳道)から入って鼓膜を振動させる。鼓膜の振動は耳小骨を経て、内耳へと伝えられる。内耳はリンパ液で満たされており、ここに有毛細胞が存在する。有毛細胞の表面(アピカル面)には不動毛と呼ばれる毛が生えており、音によりリンパ液が振動すると有毛細胞は脱分極する。これは一種のメカノトランスダクションである(本用語集を参照)。有毛細胞は聴神経とシナプスを形成しており、音刺激で生じた脱分極でのシグナルは脳へと伝えられて、音として認知される。 このいずれの箇所が障害されても難聴の原因となるが、音を感知する上での鍵となる構造は有毛細胞の不動毛と考えられている。不動毛を構成する細胞骨格はアクチン繊維の束であり、その意味で上皮細胞の微絨毛や培養細胞のフィロポディアと相同性が高い。不動毛には細胞質へ伸びる根が存在し、これもアクチン束で構成されている。この根が欠損すると不動毛の剛性が下がり、軽い振動刺激でも大きく揺れて変性してしまう。不動毛は音を感知するために揺れ動かなければならないが、根はその機械的ストレスから不動毛や有毛細胞を守っていると考えられる。 この根の知見はTRIOBP(本用語集「TRIOBP」の稿を参照)の解析から得られたものであるが、その端緒はヒト遺伝性難聴家系からTRIOBP遺伝子変異が同定されたことによる。有毛細胞で機能しているミオシン、カドヘリン、プロトカドヘリンなどの分子の大多数は、同様にヒト難聴者のゲノム解析で見出されてきた。聴覚には各分子の厳密な制御が必要なため、他の臓器では異常をきたさないような変異でも難聴をきたすことや、難聴は致死的疾患ではないため、ヒト難聴家系が多く存在するのである。 音という物理的振動を、周波数(音の高さ)や振幅(音の強さ)情報を含めて、しかもミリ秒単位での時間的変化に対応して感知するためには、有毛細胞の形態および神経など周囲の細胞との連携が厳密に制御される必要がある。有毛細胞は上皮細胞としての性格を有し、細胞間接着が非常に発達しているとともに、不動毛の形態は平面内細胞極性(planar cell polarity)を顕著に示す。同時にシナプスを有し、神経系のモデルともなる。有毛細胞で発現している分子の多くは内耳以外にも発現しており、有毛細胞は幅広い生命現象のモデルとして活用できる。 参考文献Frolenkov GI, Belyantseva IA, Friedman TB, Griffith AJ. (2004) Nat Rev Genet 5:489-498.
Kitajiri S, Sakamoto T, Belyantseva IA, Goodyear RJ, Stepanyan R, Fujiwara I, Bird JE, Riazuddin S, Riazuddin S, Ahmed ZM, Hinshaw JE, Sellers J, Bartles JR, Hammer JA 3rd, Richardson GP, Griffith AJ, Frolenkov GI, Friedman TB. (2010) Cell 141:786-798. |

 HOME
HOME