- ホーム
- >
- 細胞生物学用語集トップ
- >
- 細胞生物学用語集【か行】
細胞生物学用語集【か行】
【か】
| αカテニン |
|---|
| 【a-catenin】 |
| 米村 重信 |
| 理化学研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
主要な細胞接着分子カドヘリン(cadherin)に対して、βカテニン(β-catenin)とともに複合体を作り、カドヘリンに依存する細胞接着に対して必須な役割を果たすタンパク質。神経系ではαNカテニンという非常に近縁のタンパク質が発現しており、それに対して一般に見られるのはαEカテニンと呼ばれる。カドヘリン接着に関してはアクチン細胞骨格との結合に関わっているという細胞内のデータやアクチン繊維との結合の生化学的データが示されている。一方、カドヘリンカテニン複合体の状態ではアクチン繊維との生化学的な結合は認められず、細胞内でもアクチン繊維結合に対して何らかの制御があると考えられる。カドヘリンを主要な接着分子とするアドへレンス・ジャンクション(adherens junction)において、カドヘリンカテニン複合体が張力を受けた時に、αカテニンはアドへレンス・ジャンクションの主要なアクチン結合タンパク質ビンキュリン(vinculin)と結合するようになる(アドへレンス・ジャンクションを補強する)機能を持ち、メカノトランスダクション(mechanotransduction)を担っているタンパク質の一つである。また、細胞接着以外に細胞の増殖などにも関与している。参考文献 |
| 隔離膜 |
|---|
| 【isolation membrane 】 |
| 田端 桂介 |
| 大阪大学大学院医学系研究科遺伝学教室 |
| お問合せ |
隔離膜とは、オートファゴソーム形成前に出来てくる扁平な膜構造体のことである。 Atg5-Atg12-Atg16L複合体が隔離膜上に局在するが、閉じた構造のオートファゴソームになると複合体は解離する。そのためAtg5-Atg12-Atg16L複合体は隔離膜のマーカータンパク質として顕微鏡観察で使用される。隔離膜形成については参考文献中にあるように、小胞体(ER)と一部が連結している様子が観察されている。参考文献Hayashi-Nishimo M et al., Nature Cell Biol. 11, 1433-1437, 2009 |
【き】
| 筋原線維(筋原繊維) |
|---|
| 【Myofibril】 |
| 遠藤 剛 |
| 千葉大学大学院理学研究科 |
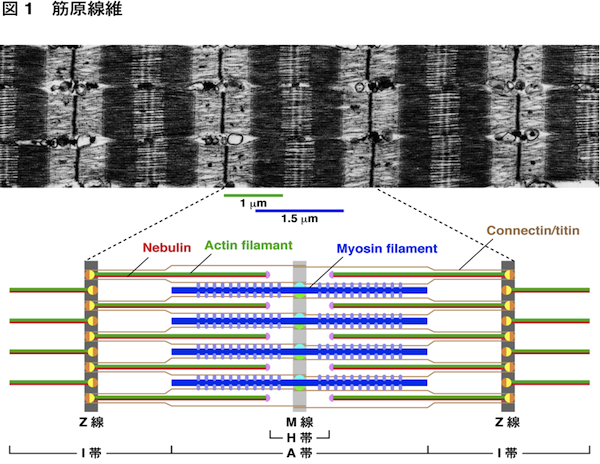
| 骨格筋や心筋は収縮することにより,からだの各部の動きや心臓の拍動を担っている.この収縮を担っている筋細胞内の構造が筋原線維である.筋原線維は直径が約1 μmで細長い円筒状の構造で,筋細胞内にぎっしり詰まっている.筋原線維を構成するミオシン線維がアクチン線維をたぐり寄せて滑り込ませることにより,筋収縮が起こる.アクチン線維は長さが約1 μmに揃っている.その反やじり端はZ線(Z帯,Z盤)に入り込んでおり,Z線で固定されている.一方,ミオシン線維は長さが約1.5 μmに揃っている.中央のM線(M帯)から両側に向かって伸びており,M線で固定されている.Z線から次のZ線の間をサルコメア(sarcomere)と呼び,筋原線維の構成単位である.
コネクチン/タイチン(connectin/titin)は分子量が3,000-3,700 kDaの最大のタンパク質であり,Z線とM線をつないでいる.ばねの働きをする部位があり,ミオシン線維をサルコメアの中央に位置させたり,受動的張力によりサルコメアの長さを保持している.またネブリン(nebulin)は骨格筋特異的に発現している分子量が600-900 kDa,長さが約1 μmの巨大タンパク質で,Z線からアクチン線維のほぼ全長にわたって伸びている.Z線からアクチン線維が形成される時には,ネブリンに沿って伸長する.心筋にはネブリンは存在せず,代わりに長さが約0.15 μmのネブレット(nebulette)が存在している.α-アクチニン(α-actinin)はZ線に局在して,アクチン線維同士を架橋している.アクチン線維の溝に沿って,トロポミオシン(tropomyosin)とそれに結合したトロポニン(troponin)複合体(T, I, Cの3つのサブユニットから成る)が存在している.トロポニンはミオシンとアクチンの相互作用を阻害するが,トロポニンにCa2+が結合することにより,この阻害が解除されて筋収縮が起こる.筋原線維中のトロポミオシン-トロポニンを含むアクチン線維を細い線維(thin filament)と呼ぶ.一方,ミオシン線維には,ミオシン結合タンパク質C(MyBP-C),M線に局在するMタンパク質(M-protein)やマイオメシン(myomesin)などが結合している.筋原線維中のこれらのタンパク質を結合したミオシン線維を太い線維(thick filament)と呼ぶ.筋原線維にはこれらのタンパク質以外にもいくつものタンパク質が存在するが,機能が十分に解明されていないものも多い. 筋細胞はインスリン様増殖因子1(IGF-1)が作用することによって肥大するが,その過程で筋原線維が形成される.IGF-1によって活性化されたホスファチジルイノシトール3-キナーゼ(PI3K)-Aktシグナリングを介して,Z線でネブリンのC末端にN-WASPが結合する.この複合体がアクチン重合核形成因子として働き,Z線でアクチン重合核が形成される.さらにZ線からネブリンに沿ってアクチン線維が伸長する.こうして筋原線維のアクチン線維が形成される.一方,IGF-1によるミオシン線維形成の機構はまだ不明である. 参考文献(1) Clark, K.A., et al. (2002) Annu. Rev. Cell Dev. Biol. 18, 637-706.
(2) Lange, S., Ehler, E., Gautel, M. (2006) Trends Cell Biol. 16, 11-18. (3) 高野和儀,遠藤 剛 (2011) ライフサイエンス新着論文レビュー (4) 高野和儀,渡邊-高野晴子,遠藤 剛 (2011) 実験医学 29, 1273-1276. |
【け】
| 蛍光1分子イメージング法 |
|---|
| 【Single fluorescent molecule imaging technique】 |
| 原田 慶恵 |
| 京都大学 物質-細胞統合システム拠点(iCeMS) |
| お問合せ |
| 蛍光色素、蛍光タンパク質、量子ドットなどの蛍光物質を個々の生体分子に標識して蛍光顕微鏡と高感度カメラを使って個々の分子を観察する方法である。特に、蛍光色素や蛍光タンパク質の場合は、微弱な蛍光を検出しなければならない。そのため、背景光を激減させることができるエバネッセント照明を組み込んだエバネッセント蛍光顕微鏡を使う。レーザーと光学部品を使ってエバネッセント照明の光学系を自作することもできるが、対物レンズ型エバネッセント照明を組み込んだ顕微鏡システムも市販されている。 エバネッセント照明法ではガラス基板から100nm程度の深さまでしか観察できないので細胞表面の観察は可能であるが、細胞の中を観察する実験には用いることができない。そこで考案されたのが斜光照明法である。斜光照明法を用いることで、細胞内の蛍光色素分子も1分子イメージングが可能になる。さまざまな蛍光プローブのうち、量子ドットは非常に明るく、退色しないので、in vitroの実験だけでなく、細胞内や個体内で1分子を追跡する実験に用いられている。 |
| 原形質と後形質 |
|---|
| 【protoplasm】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| 原形質はprotoplasm,後形質はmetaplasm。前者は細胞の中の「生きている」部分,後者は原形質の活動によって後から作られた「生きていない」部分,というのがもともとの定義であった。後形質としては,たとえば植物の細胞壁や液胞がそうであるとされたが,今となってはこれが全くナンセンスであるのは明らかだろう。細胞壁や液胞も立派な生命活動の場なのだから。顕微鏡による細胞内微細構造の知識もなかった時代に使われた言葉であり,今では死語となったと考えるべきである。しかし,その派生語としては現在も使われるものが少なくない。たとえば,原形質流動(cytoplasmic streaming),原形質連絡(plasmodesmata),原形質糸(transvacuolar strands)など,植物分野でよく生き残っているように思われる。ただ,これも英語の方を見てもらえばわかるように,protoplasmという表現はもうほとんど使われていない。唯一,英語でもなごりが残るのがprotoplastsという言葉。プロトプラストとは,細胞壁を酵素処理して除き,細胞膜が露出した状態の細胞のことであり,これは現在でも頻繁に使われる。酵母では,同様に細胞壁を除いた細胞のことをスフェロプラストと呼ぶが,これは酵素処理しても細胞壁成分が完全には除き切れていないから。 |
| 原子間力顕微鏡 |
|---|
| 【Atomic Force Microscopy】 |
| 芳賀 永 |
| 北海道大学大学院生命科学院 |
| お問合せ |
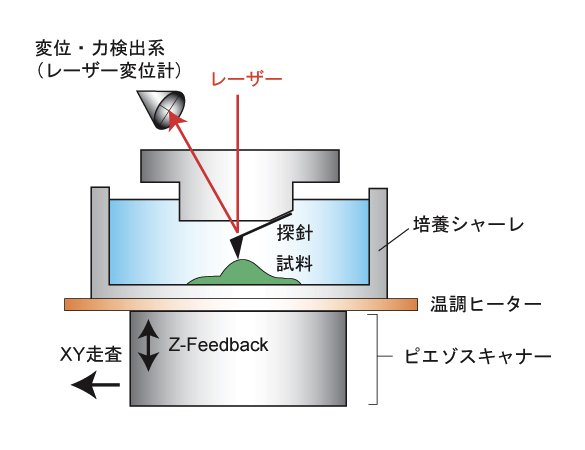
| 原子間力顕微鏡(Atomic Force Microscopy; 以下 AFM)は、生体試料の表面形状を測定することができる装置である。AFMは電子顕微鏡とは異なり、試料の固定処理を必要とせず、タンパク質や細胞の3次元的な形状を培養環境下で直接観察することが可能である。 また、カンチレバーとよばれる板バネの先端に長さ数ミクロン程度の針がついた探針を試料表面に直接接触させながら形状測定を行うため、カンチレバーのなぞり方を工夫することで、試料の形状だけではなく力学的性質(弾性率や粘着力など)の計測が可能となる(図)。 現在、AFMを用いた弾性率測定の主流はコンタクトフォースモードと呼ばれる測定法である。コンタクトフォースモードとは、探針を試料に押し込むことでカンチレバーに発生する力と試料の変形量との関係(フォースカーブ)を測定し、試料の弾性率を定量的に計測する測定法である。例えば、測定領域を64×64ピクセルに分割して、各点でフォースカーブを取得し、ピクセルごとに得られた弾性率を画像化(マッピング)することで硬さの空間分布像を得ることができる。 また、タンパク質分子のN末端とC末端をそれぞれ基盤とカンチレバーに結合させ、両端を引っ張ることにより発生する力を計測することで、タンパク質分子の折り畳みエネルギーや分子内のドメイン構造に関する情報を得ることができる。 この他、試料表面の走査を高速化することで、タンパク質一分子の移動や形の変化をビデオレートでイメージングする技術も開発されている。 参考文献 |
【こ】
| コフィリンによるアクチン骨格の制御 |
|---|
| 【Regulation of actin cytoskeleton remodeling by cofilin】 |
| 大橋 一正 |
| 東北大学大学院生命科学研究科 |
| コフィリンは、アクチン繊維を切断・脱重合する活性をもつ20 kDaのアクチン結合タンパク質である。酵母から存在し、生存に必須であり、ヒトまで高度に保存されている。コフィリンは、ヒトで遺伝子の異なる筋肉型、非筋肉型、Actin depolymerizing factor (ADF)の3種類が存在する。細胞内の数μモルの濃度で存在する。試験管内の実験により、繊維状のF-アクチン, 単量体のG-アクチンどちらにも結合することが明らかとなっている。また、ADP結合型のアクチンに対してより高い親和性を持ち、ADPの加水分解とリン酸の放出が進んだ古いアクチン線維を切断・脱重合すると考えられている。アクチン繊維の脱重合と切断は異なる作用で、アクチン線維のマイナス端からアクチンの脱重合する活性と、アクチン線維の側面に結合し、アクチン線維のらせん構造をよりねじれた状態にすることで不安定化して切断する作用があると考えられている。
細胞内における基本的なコフィリンの機能は、アクチン線維を切断・脱重合しアクチン骨格の流動性を生みだす働きである。細胞内のコフィリンの発現抑制や不活性化は、細胞内アクチンの過重合により重合と脱重合のターンオーバー速度の低下を引き起こし、アクチンの流動性が失われ、細胞は全く運動できない状態になる。 コフィリンのアクチン脱重合・切断活性に対する制御は、主に、ホスファチジルイノシトール4,5ビスリン酸(PIP2)との結合によるアクチン線維への結合阻害、3番目のセリン残基のリン酸化によるアクチン結合活性の不活性化、Actin interacting protein 1 (Aip1),アデニル酸シクラーゼ結合蛋白質(CAP)との結合による活性促進の制御が知られている。コフィリンのリン酸制御は、リン酸化酵素としてLIMキナーゼファミリー(LIMK1, LIMK2, TESK1, TESK2)が働き、脱リン酸化酵素としてSlingshotファミリー(Slingshot-1, Slingshot-2, Slingshot-3)が働く。これ以外にPP1, PP2A, ハロ酸デヒドロゲナーゼの一つでタンパク質脱リン酸化酵素として働くChronophinが脱リン酸化酵素として働くことが報告されている。コフィリンのリン酸化制御は、進化的にショウジョウバエ以降で保存されており、酵母にはLIMキナーゼ、Slingshotに相同な遺伝子は存在しない。 LIMキナーゼは、 LIMK1, LIMK2共に低分子量Gタンパク質Rhoファミリーの下流エフェクターのリン酸化酵素ROCK, PAKによってリン酸化され活性化される。LIMK1は、細胞移動に必要であり、ラメリポディア形成、ストレスファイバー形成において部分的に寄与する働きを持つと考えられている。Slingshotは、Slingshot-1について解析が進んでおり、アクチン線維と結合して強く活性化されること、Rhoファミリーの一つであるRacやPI3キナーゼの下流で活性化されること、Ca2+シグナルの下流でカルシニューリンによって活性化されることが報告されている。細胞外からの刺激依存的にLIMキナーゼと共に活性化され、コフィリンのリン酸化のターンオーバーを促進することでアクチン骨格の再構築に寄与すると考えられる。 参考文献 |
| ゴルジ体とトランスゴルジ網 |
|---|
| 【golgi body】 |
| 中野 明彦 |
| 東京大学 大学院理学系研究科 生物科学専攻 |
| ゴルジ体の構造は,一部の出芽酵母(たとえばSaccharomyces cerevisiae)のように,ゴルジ槽(Golgi cisternae)が層板構造をとらず細胞質中に散らばっているものから,植物や無脊椎動物のようにゴルジ槽が積み重なったゴルジ層板(Golgi stacks)が1つ1つ独立して存在するもの,哺乳動物のように巨大なゴルジリボン(Golgi ribbon)を形成するもの,と生物種によってさまざまである。しかし,その共通の特長として,入り口であるcis側から出口であるtrans側へ向けての機能的な勾配はよく保存されている。形態的に,cisとtransの端では,層板構造に連なる網状構造が見られることが古くから知られ,それぞれcis-Golgi network (CGN), trans-Golgi network (TGN)と呼ばれた。CGNは,ゴルジ層板近傍の中間区画(ERGIC)に相当すると考えると理解しやすい。一方TGN(日本語ではトランスゴルジ網と呼ぶ)については,ゴルジ体とは独立した別個の細胞小器官と考えた方がよいという考え方が浮上している。ゴルジ体の層板内を徐々に進行してきた積み荷タンパク質は,一旦TGNに到達した後,さまざまな目的地ごとに選別される。TGNがそこで果たす機能はきわめて多様であり,専門化した選別ステーションと考えるべきではないかというものである。驚くべきことに,TGNは植物では初期エンドソーム(early endosomes)としての機能ももつことが明らかになり,再循環エンドソーム(recycling endosomes)ときわめて近い役割をもつことも示されつつある。今後の研究の進展に目が離せない区画である。 |
| ゴルジ体ストレス応答 |
|---|
| 【Golgi stress response】 |
| 吉田 秀郎 |
| 兵庫県立大学大学院生命理学研究科生体物質化学II講座 |
ゴルジ体の機能が不足した際に、ゴルジ体の機能を強化し、ゴルジ体の恒常性を維持する機構。ゴルジ体ストレス時に転写制御配列GASE(Golgi apparatus stress response element コンセンサス配列はACGTGGC)を介して、ゴルジ体の構造形成因子や糖鎖修飾酵素、小胞輸送因子の遺伝子の転写が誘導されることがわかっているが、転写制御の詳細な機構は未知である。参考文献Cell Struct. Funct. (2011) 36, 1-12 |
| 古典的MAPs |
|---|
| 【Classical Microtubule-Associated Proteins】 |
| 久永 眞市 |
| 首都大学東京 / 大学院・理工学研究科 |
| お問合せ |
微小管(microtubule)を組織(主に哺乳動物の脳)や細胞から、重合・脱重合を繰り返して単離した時に、微小管を構成するチューブリン(tubulin)とともに取れてくるタンパク質で、微小管の重合や安定化活性をもつ因子。最初に見つかった微小管結合タンパク質(MAP)のため、古典的(classical)と呼ばれている。また、酵素活性など持たず、微小管壁に結合して、微小管間の距離を調節することから、構造的(Structural)MAPとも呼ばれることもある。MAP1ファミリーとMAP2/MAP4/Tauファミリーからなる。MAP1ファミリーにはMAP1A、MAP1B、MAP1Sがある。MAP1AとMAP1Bは主に神経細胞で発現し、MAP1Bは発達期の神経細胞で特に軸索(axon)に存在し、MAP1Aは成熟した脳の神経細胞の樹状突起(dendrite)に存在する。MAP1Sは多くの組織で発現している。いずれのMAP1も全長が翻訳された後、C末側の微小管に結合できる部分(軽鎖)が切断され、残りのN末側(重鎖)と複合体を形成して微小管に結合する。MAP1の軽鎖としてLC3も知られているが、これは最近オートファジー(autophagy)に関連する因子であることが判明している。MAP1は微小管安定化能を持つが、後述のMAP2よりは弱い。アクチンフィラメント(actin filament)にも結合できる。MAP2/MAP4/Tauファミリーは熱安定性で、特定の構造をもたない繊維状のタンパク質である。C末側に3-5つの微小管結合配列からなる微小管結合領域を持つ。N末側は微小管の外へ伸び出し、微小管間の距離を規定したり、他のタンパク質の結合部位となっている。微小管結合領域はアクチンとも結合でき、N末突起領域を介して、微小管とアクチンフィラメントの架橋をしている場合もある。MAP2とTauは主に神経系の細胞で発現しているが、神経細胞ではMAP2は主に樹状突起に、Tauは軸索に存在しており、それぞれの神経突起を区別するマーカーとしてよく使われている。MAP4は神経細胞以外の多くの組織や細胞でも発現している。特に増殖細胞での分裂間期と分裂期の微小管の動態(安定性)変化に大きく寄与していると考えられている。このファミリータンパクの微小管重合能はリン酸化によって制御されている。複数のプロテインキナーゼによってリン酸化され、リン酸化により微小管結合および重合能が低下する。特にTauのリン酸化はアルツハイマー病(Alzheimer's disease)で見られる神経原繊維変化(neurofibrillary tangle)の主要構成成分であることから注目をされている。また、Tau自身も前頭側頭葉型認知症(FTDP-17)の原因遺伝子であることが判っている。参考文献 |
| 酵母のアクチン細胞骨格 |
|---|
| 【The actin cytoskeleton in yeasts】 |
| 中野 賢太郎 |
| 筑波大学大学院生命環境科学研究科 |
| お問合せ |
| 基礎研究に用いられる酵母は、主に出芽酵母 (budding yeast, Saccharomyces cerevisiae) と分裂酵母 (fission yeast, Schizosaccharomyces pombe) である。両者の進化系統の隔たりは大きいが、アクチン細胞骨格 (actin cytoskeleton) の性状については共通性が高い。そのため、酵母の研究から得られた知見は、真菌類のみならず真核生物全般にも当てはまる場合が多い。酵母の実験系では、条件致死性を利用した遺伝学的解析や相同組換えによる目的遺伝子の破壊が容易であり、細胞機能に必須な遺伝子の機能解析が自在に出来る。この特質により、アクチン、及びその調節タンパク質の細胞内の分子機能の研究において、両酵母は重要な地位を占める。
酵母には、アクチンパッチ (actin patch)、アクチンケーブル (actin cable)、そしてアクチンリング (actin ring) の3種類の構造が認められる。アクチンパッチは細胞質側に貫入した細胞膜領域を覆うように比較的短いアクチン繊維が取り巻いたもので、エンドサイトーシス (endocytosis) の際に小胞を切り離す役割を担う。通常、細胞の成長領域や分裂面では、複数のアクチンパッチが頻繁に形成と解体を繰り返す。また、それらの細胞領域から細胞質中に数本のアクチンケーブルが伸長する。これはV型ミオシン (myosin V) のレールであり、成長領域への物質輸送に寄与する。一方、アクチンリングは分裂期にのみ出現する構造で、II型ミオシン (myosin II) を構成成分として含む。これは動物細胞の収縮環に相当し、細胞質分裂 (cytokinesis) に伴い、その径を縮める。補足すると、アクチンリングの収縮に付随して、分裂面に新しい細胞壁(隔壁)が新生されることも酵母の細胞質分裂には重要である。なお酵母においては、動物細胞のように細胞膜直下を裏打ちするアクチン細胞骨格のメッシュワークは報告されていない。このような構造は、細胞壁で被われた酵母には不要なのだろう。 上記の3種類の構造の構築において、先導的な役割を担うアクチン重合促進タンパク質は、アクチンパッチでは Arp2/3 複合体 (Arp2/3 complex) が、アクチンケーブルやアクチンリングではフォルミン (formin) である。これらの活性は、Rho ファミリーの低分子量 GTPase の制御下に置かれているらしい。またアクチン束化タンパク質 (actin-bundling protein) やキャッピングタンパク質 (actin-capping protein) 、脱重合タンパク質 (actin-depolymerizing factor) などについても、動物細胞や植物細胞のものと酵母のものとで共通性が高い。 参考文献 |
| 酵母の核分裂 |
|---|
| 【Closed mitosis: nuclear division in yeast】 |
| 新井 邦生・佐藤 政充 |
| 東京大学大学院理学系研究科生物化学専攻 |
| お問合せ |
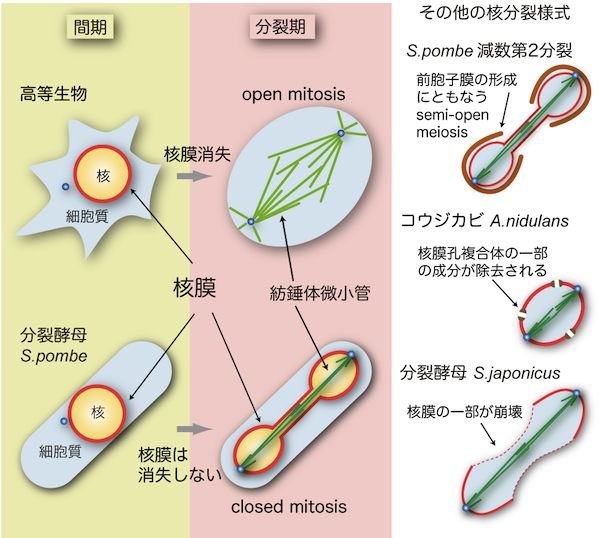
| 酵母における細胞分裂は、基本的には高等生物の細胞分裂と類似しているが、分裂期に核膜が崩壊しないことが構造上の最も大きな違いである。
高等生物では、分裂期に核膜が消失する(nuclear envelope break down, NEBD)ため、その形態はopen mitosisと呼ばれる。酵母を含む多くの単細胞生物では分裂期でも核膜が崩壊せず、closed mitosisと呼ばれる(図参照)[1]。したがって、Ran GTPaseによって統括される核・細胞質間の物質輸送は分裂期にも機能する。紡錘体微小管は核内に形成される必要がある(「酵母の紡錘体微小管」「酵母の中心体」の項を参照)が、Ranが輸送する重要な積み荷として、紡錘体微小管の形成に重要な役割を果たすAlp7/TACC (transforming acidic coiled-coil)タンパク質が知られている[2]。分裂後期(anaphase)には、紡錘体微小管が伸長することで核膜が維持されたまま核が2個に分裂する。このように、体細胞分裂において核分裂をおこすためには紡錘体微小管の伸長が不可欠である。 酵母の核分裂はclosed mitosisのみだと長らく信じられてきた。しかし近年、分裂酵母S. pombeの減数第2分裂においては、核膜は崩壊しないものの、核・細胞質間を隔てる機能が失われることが分かった(semi-open meiosis, virtual open meiosisと呼ぶ;図参照)[3,4]。減数第2分裂では配偶子(胞子)を作るために、核膜のまわりに前胞子膜(forespore membrane)と呼ばれる膜を形成する。前胞子膜が形成されることで、核膜あるいは核膜孔複合体(nuclear pore complex)にも連動して影響が生じている可能性がある。 コウジカビA. nidulansは分裂期に核膜孔複合体の一部の成分が除去されることで核・細胞質間の隔たりが無効化されるsemi-open mitosisをおこなう[5]。また、S. pombe近縁種の分裂酵母S. japonicusでは、体細胞分裂時に核膜の一部が崩壊することが分かった(図参照)[6]。このように、酵母やカビに限っても核分裂には様々な様式があることが明らかになってきた。それぞれの様式にどのような利点があるのかは推測の域を出ないが、各生物の生態に密接に関連した様式の核分裂をおこなっているのかもしれない。 参考文献 |
| 酵母の極性と輸送 |
|---|
| 【cell polarity and polarized transport in yeast】 |
| 田中 一馬 |
| 北海道大学 遺伝子病制御研究所 疾患制御部門 分子間情報分野 |
細胞極性形成の基本的な過程は、(1) 位置のシグナル(polarity cue)、(2) 位置のシグナルからのシグナルの伝達 (signal transduction)、(3) 細胞骨格の再編成、(4) 極性輸送(polarized transport)から成る。出芽酵母の場合、(1)は出芽痕に関連しており特異的であるが、(2)、 (3)、 (4)は真核細胞に広く見られるメカニズムである。特に(2)の中心を成すのはCdc42低分子量GTP結合タンパク質(small GTPase)とそのエフェクター(effector)群であり、エフェクターの中にはフォルミン(formin)のように(3)において重要な役割を果たすタンパク質もある。酵母において輸送の原動力はミオシンV(Myo2)であって、アクチンケーブル(actin cable)に沿って輸送小胞(transport vesicles)やmRNAなどを極性形成部位へ輸送する。輸送小胞の極性形成部位近傍の細胞膜(plasma membrane)への融合はそのまま極性成長(polarized growth)へと繋がる。参考文献 |
| 酵母の中心体:スピンドル極体 |
|---|
| 【SPB: spindle pole body】 |
| 戸谷 美夏 |
| 理化学研究所 神戸研究所 発生・再生科学総合研究センター (CDB) |
| お問合せ |
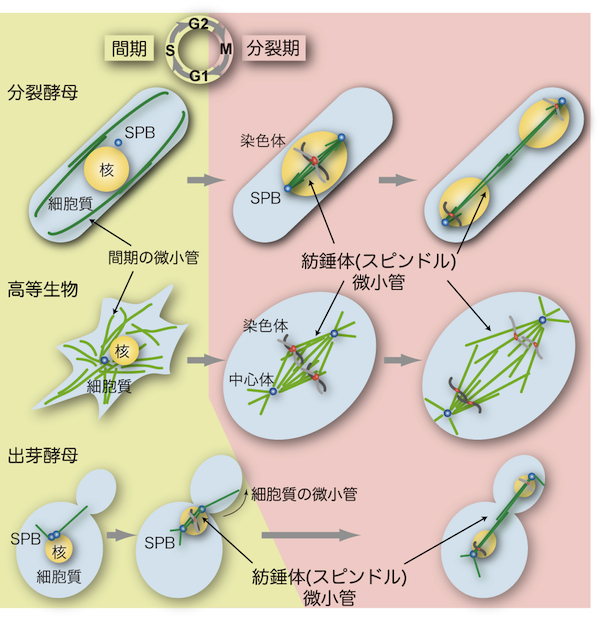
| 酵母は、動物細胞における中心体に相当する細胞内小器官として、スピンドル極体 (SPBと呼ばれることが多い)をもつ。SPBは、直径約100nm程度の円盤が重なったような、中心体とは大きく異なる構造をもつが、中心体と同様に、細胞内で微小管形成中心(MTOC: microtubule organizing center)として働いている(図参照)。SPBと中心体には、微小管の形成起点となるγチューブリン複合体 (γ-tubulin complex) が局在する。それ以外にも、SPBと中心体を構成する因子には、互いに機能的な相同性をもつタンパク質が多く含まれる。 細胞分裂時には、 SPBは、 スピンドル微小管(高等生物の紡錘体:「酵母の紡錘体微小管」の項を参照)の形成起点として両極に存在し、微小管のマイナス端を繋ぎ止めて、精確な染色体の分配に貢献している。細胞分裂により母娘細胞に分配されたSPBは、1細胞周期に1回だけの複製を行って、細胞内での数を保っている。 酵母では、細胞分裂期にも核膜が消失しないため、SPBは、核膜に埋め込まれて、核内にスピンドル微小管を形成する(「酵母の核分裂」の項を参照)。 出芽酵母のSPBは、 複製されたばかりの新しいSPBが一過的に核膜の外に観察されるが、すぐに核膜に埋め込まれ、 その後は細胞周期を通して核膜に埋め込まれて存在する。分裂酵母のSPBは、分裂期にのみ核膜に埋め込まれて核内にスピンドル微小管を形成する。間期には、核膜に添うように細胞質側に存在し、細胞質微小管のMTOCのひとつとして働いている。 減数分裂では、染色体組換えの時期に、核内の微小管がSPBによってひとつに束ねられる。分裂酵母では、SPBが先頭になって核を引っ張りまわすように動き、相同染色体の効率的な組換えを可能にしている(「酵母の微小管」の項を参照)。 SPBと中心体は、MTOCとしての働きのほかにも、情報伝達分子の足場としての役割をもつ。分裂期に重要な複数のキナーゼが、 SPB・中心体に局在することが知られている。分裂酵母では隔壁形成を制御する分子群(SIN: septation initiation network)、出芽酵母では分裂期脱出を制御する分子群 (MEN: mitosis exit network)なども、SPBに局在する。複製されたSPBが等価ではない(成熟度の違いによってOldとNewの区別が生じる)ことを利用した、非対称や極性の制御に関わるしくみの存在が示唆される。細胞分裂に非対称性を与えることも、SPB・中心体の重要な役割であると考えられる。 参考文献 |
| 酵母の紡錘体微小管 |
|---|
| 【Spindle microtubules in yeast】 |
| 佐藤 政充 |
| 東京大学大学院理学系研究科生物化学専攻 |
| お問合せ |
| 紡錘体(スピンドル、spindle)は微小管(microtubule)の束が多数集まって構成される細胞内の構造である。真核細胞において紡錘体はゲノム染色体を2個の娘細胞に分配するために必要不可欠の役割を担う(「紡錘体微小管」の項を参照)。酵母における紡錘体微小管の基本的な機能や性質は高等生物のものと良く似ているが、相違点もいくつかある。 高等生物では一般的に紡錘体はひし形であるが、酵母では微小管が束ねられて直線状の形を示す(図参照)。また、酵母では分裂期でも核膜が崩壊しない(closed mitosisと呼ばれる)ため、紡錘体が核内に形成されるという大きな特徴がある(「酵母の核分裂」の項を参照)。 分裂酵母では、間期(interphase)に見られる細胞質の微小管構造は分裂期(mitosis)になると消失し、かわりに核内に紡錘体微小管を形成する(図参照)[1]。このように、細胞周期の時期に応じて、微小管の形成される場所が細胞質から核へと移る。その分子メカニズムはまだ明らかにされていないが、第一に微小管を安定化するタンパク質が核内に蓄積することが重要であり、第二に微小管を形成する原点であるスピンドル極体(SPB;「酵母の中心体」の項を参照)が分裂期に核膜に埋め込まれることが必要であると考えられる[2, 3]。 これに対して、出芽酵母のSPBは細胞周期を通して常に核膜に埋め込まれているため(「酵母の中心体」の項を参照)、間期でも核内にわずかながら微小管構造が存在し[4]、分裂期に突入する前のG2期の段階で紡錘体を形成する(図参照)。さらに出芽酵母では、出芽した娘細胞に核を正しく分配させるために、細胞質の微小管が細胞の内壁をたどっていき紡錘体を回転させ(spindle orientation、図参照)、核を娘細胞へと誘導する。 紡錘体微小管は、複製された染色体の動原体部位(キネトコア、kinetochore)を接着して両極に引っ張ることで染色体を分配する。微小管の接着が未完了の場合や、不適切な接着が起きた場合には、紡錘体形成チェックポイント(spindle assembly checkpoint)と呼ばれる監視機構が活性化して、すべての動原体が微小管によって正しく捕捉されるまで細胞周期を分裂中期(metaphase)に停止させる。Mad2やBub1などのチェックポイント因子は酵母からヒトまで真核細胞生物で幅広く保存されている。 参考文献 |

 HOME
HOME